Липиды очень неоднородны
Классификация липидов сложна, так как в класс липидов входят вещества весьма разнообразные по своему строению. Их объединяет только одно свойство – гидрофобность.
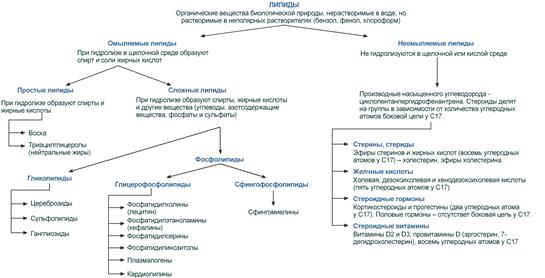
По отношению к гидролизу в щелочной среде все липиды подразделяют на две большие группы: омыляемые и неомыляемые.
Среди неомыляемых определена большая группа стероидов, в состав которой входят холестерол и его производные: стероидные гормоны, стероидные витамины, желчные кислоты.
Среди омыляемых липидов существуют простые липиды, т.е. состоящие только из спирта и жирных кислот – воска, триацилглицеролы (триглицериды), эфиры холестерола, и сложные липиды, включающие, кроме спирта и жирных кислот, вещества иного строения – фосфолипиды, гликолипиды, сфинголипиды.
Классификация липидов
Функции липидов тесно связаны с их строением
Липиды являются третьим классом органических веществ из которых состоит живой организм. Правильный качественный и количественный состав липидов клетки определяет ее возможности, активность и выживаемость. Жирнокислотный состав мембранных фосфолипидов, недостаток или избыток холестерола в мембране неизбежно влияет на деятельность мембранных белков – транспортеров, рецепторов, ионных каналов. Все это влечет за собой изменение работы клеток и, конечно, функций всего органа, как например, при инсулиннезависимом сахарном диабете. Существуют наследственные болезни накопления липидов – липидозы, сопровождающиеся тяжелыми нарушениями в организме.
Необходимость изучения строения, свойств и видов липидов кроется в многообразии из функций. Функции липидов существенно зависят от их вида.
Резервно-энергетическая функция
Триацилглицеролы подкожного жира являются основным энергетическим резервом организма при голодании. В адипоцитах жиры могут составлять 65-85% веса. Для поперечно-полосатой мускулатуры, печени и почек они являются основным источником энергии.
Структурная функция
Мембраны клеток состоят из фосфолипидов, обязательным компонентом являются гликолипиды и холестерол. Основным компонентом сурфактанта легких является фосфатидилхолин (и содержащий две пальмитиновые кислоты).
Т.к. активность мембранных ферментов зависит от состояния и текучести мембран, то жирнокислотный состав и наличие определенных видов фосфолипидов, количество холестерола влияет на активность мембранных липидзависимых ферментов (например, аденилатциклаза, Nа+,К+-АТФаза, цитохромоксидаза).
Сигнальная функция
Гликолипиды выполняют рецепторные функции и задачи взаимодействия с другими клетками. Фосфатидилинозитол непосредственно принимает участие в передаче гормональных сигналов в клетку. Производные жирных кислот – эйкозаноиды – являются «местными (тканевыми) гормонами», обеспечивая регуляцию функций клеток.
Защитная функция
Подкожный жир является хорошим термоизолирующим средством, наряду с брыжеечным жиром он обеспечивает механическую защиту внутренних органов.
Фосфолипидный фактор активации тромбоцитов участвует в агрегации тромбоцитов, играет роль как медиатор воспаления и в патогенезе анафилактического шока.
Свойства и функции липидов зависят от жирных кислот
Жирные кислоты входят в состав всех омыляемых липидов. У человека жирные кислоты характеризуются следующими общими чертами:
- четное число углеродных атомов в цепи,
- отсутствие разветвлений цепи,
- наличие двойных связей только в цис-конформации.
В свою очередь, по строению жирные кислоты неоднородны и различаются длиной цепи и количеством двойных связей.
К насыщенным жирным кислотам относится пальмитиновая (С16), стеариновая (С18) и арахиновая (С20). К мононенасыщенным – пальмитоолеиновая (С16:1, Δ9), олеиновая (С18:1, Δ9). Указанные жирные кислоты находятся в большинстве пищевых жиров и в жире человека.
Полиненасыщенные жирные кислоты содержат от 2-х и более двойных связей, разделенных метиленовой группой. Кроме отличий по количеству двойных связей, кислоты различаются положением двойных связей относительно начала цепи (обозначается через греческую букву Δ «дельта«) или последнего атома углерода цепи (обозначается буквой ω «омега«).
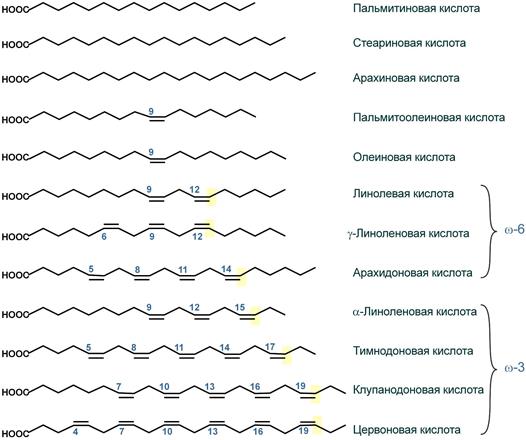
По положению двойной связи относительно последнего атома углерода полиненасыщенные жирные кислоты делят на ω9, ω6 и ω3-жирные кислоты.
1. ω6-жирные кислоты. Эти кислоты объединены под названием витамин F, и содержатся в растительных маслах.
- линолевая (С18:2, Δ9,12),
- γ-линоленовая (С18:3, Δ6,9,12),
- арахидоновая (эйкозотетраеновая, С20:4, Δ5,8,11,14).
Строение жирных кислот
2. ω3-жирные кислоты:
- α-линоленовая (С18:3, Δ9,12,15),
- тимнодоновая (эйкозопентаеновая, С20:5, Δ5,8,11,14,17),
- клупанодоновая (докозопентаеновая, С22:5, Δ7,10,13,16,19),
- цервоновая (докозогексаеновая, С22:6, Δ4,7,10,13,16,19).
Пищевые источники
Поскольку жирные кислоты определяют свойства молекул, в состав которых они входят, то они находятся в совершенно разных продуктах. Источником насыщенных и мононенасыщенных жирных кислот являются твердые жиры – сливочное масло, сыр и другие молочные продукты, свиное сало и говяжий жир.
Полиненасыщенные ω6-жирные кислоты в большом количестве представлены в растительных маслах (кроме оливкового и пальмового) – подсолнечное, конопляное, льняное масло. В небольшом количестве арахидоновая кислота имеется также в свином жире и молокопродуктах.
Наиболее значительным источником ω3-жирных кислот служит жир рыб холодных морей – в первую очередь жир трески. Исключением является α-линоленовая кислота, имеющаяся в конопляном, льняном, кукурузном маслах.
Роль жирных кислот
1. Именно с жирными кислотами связана самая известная функция липидов – энергетическая. Благодаря окислению насыщенных жирных кислот ткани организма получают более половины всей энергии (β-окисление), только эритроциты и нервные клетки не используют их в этом качестве. Как энергетический субстрат используются, как правило, насыщенные и мононенасыщенные жирные кислоты.
2. Жирные кислоты входят в состав фосфолипидов и триацилглицеролов. Наличие полиненасыщенных жирных кислот определяет биологическую активность фосфолипидов, свойства биологических мембран, взаимодействие фосфолипидов с мембранными белками и их транспортную и рецепторную активность.
3. Для длинноцепочечных (С22, С24) полиненасыщенных жирных кислот установлено участие в механизмах запоминания и поведенческих реакциях.
4. Еще одна, и очень важная функция ненасыщенных жирных кислот, а именно тех, которые содержат 20 углеродных атомов и формируют группу эйкозановых кислот (эйкозотриеновая (С20:3), арахидоновая (С20:4), тимнодоновая (С20:5)), заключается в том, что они являются субстратом для синтеза эйкозаноидов (перейти) – биологически активных веществ, изменяющих количество цАМФ и цГМФ в клетке, модулирующих метаболизм и активность как самой клетки, так и окружающих клеток. Иначе эти вещества называют местные или тканевые гормоны.
NB! Внимание исследователей к ω3-кислотам привлек феномен эскимосов (коренных жителей Гренландии) и коренных народов российского Заполярья. Несмотря на высокое потребление животного белка и жира и очень незначительное количестве растительных продуктов у них отмечалось состояние, которое назвали антиатеросклероз. Это состояние характеризуется рядом положительных особенностей:
- отсутствие заболеваемости атеросклерозом, ишемической болезнью сердца и инфарктом миокарда, инсультом, гипертонией;
- увеличенное содержание липопротеинов высокой плотности (ЛПВП) в плазме крови, уменьшение концентрации общего холестерина и липопротеинов низкой плотности (ЛПНП);
- сниженная агрегация тромбоцитов, невысокая вязкость крови;
- иной жирнокислотный состав мембран клеток по сравнению с европейцами – С20:5 было в 4 раза больше, С22:6 в 16 раз!
NB! 1. В экспериментах по изучению патогенеза сахарного диабета 1 типа у крыс было обнаружено, что предварительное применение ω-3 жирных кислот снижало у экспериментальных крыс гибель β-клеток поджелудочной железы при использовании токсичного соединения аллоксан (аллоксановый диабет).
2. Показания к применению ω-3 жирных кислот:
- профилактика и лечение тромбозов и атеросклероза,
- инсулинзависимый и инсулиннезависимый сахарный диабет, диабетические ретинопатии,
- дислипопротеинемии, гиперхолестеролемия, гипертриацилглицеролемия, дискинезии желчевыводящих путей,
- аритмии миокарда (улучшение проводимости и ритмичности),
- нарушение периферического кровообращения.
У эйкозаноидов широкие возможности
К эйкозаноидам (είκοσι, греч.-двадцать) относят окисленные производные эйкозановых кислот: эйкозотриеновой (С20:3), арахидоновой (С20:4), тимнодоновой (С20:5) жирных кислот. Активность эйкозаноидов значительно разнится от числа двойных связей в молекуле, которое зависит от строения исходной жирной кислоты.
Выделяют три основные группы эйкозаноидов: простагландины, лейкотриены, тромбоксаны.
NB! Простагландины (Pg) синтезируются практически во всех клетках, кроме эритроцитов и лимфоцитов. Выделяют типы простагландинов A, B, C, D, E, F. Функции простагландинов сводятся к изменению тонуса гладких мышц бронхов, мочеполовой и сосудистой системы, желудочно-кишечного тракта, при этом направленность изменений различна в зависимости от типа простагландинов, типа клетки и условий. Они также влияют на температуру тела.
Простациклины являются подвидом простагландинов (Pg I), вызывают дилатацию мелких сосудов, но еще обладают особой функцией – ингибируют агрегацию тромбоцитов. Их активность возрастает при увеличении числа двойных связей в исходных жирных кислотах. Синтезируются в эндотелии сосудов миокарда, матки, слизистой желудка.
Тромбоксаны (Tx) образуются в тромбоцитах, стимулируют их агрегацию и вызывают сужение сосудов. Их активность снижается при увеличении числа двойных связей в исходных жирных кислотах.
Лейкотриены (Lt) синтезируются в лейкоцитах, в клетках легких, селезенки, мозга, сердца. Выделяют 6 типов лейкотриенов A, B, C, D, E, F. В лейкоцитах они стимулируют подвижность, хемотаксис и миграцию клеток в очаг воспаления, в целом они активируют реакции воспаления, предотвращая его хронизацию. Также вызывают сокращение мускулатуры бронхов (в дозах в 100-1000 раз меньших, чем гистамин).
Депонироваться эйкозаноиды не могут, разрушаются в течение нескольких секунд, и поэтому клетка должна синтезировать их постоянно из поступающих жирных кислот ω6- и ω3-ряда.
Синтез эйкозаноидов
Источником свободных эйкозановых кислот являются фосфолипиды клеточной мембраны.
Под влиянием гистамина, комплекса антиген-антитело, цитокинов, кининов активируются фосфолипаза А2 или комбинация фосфолипазы С и ДАГ-липазы, которые отщепляют жирную кислоту из положения С2 мембранных фосфолипидов
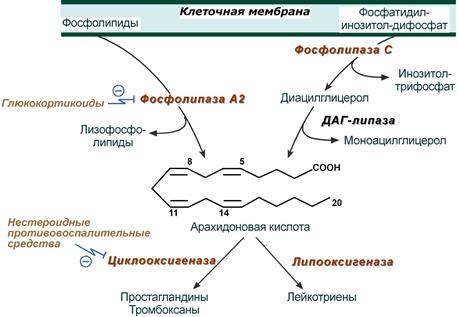
Синтез эйкозаноидов на примере арахидоновой кислоты.
Химизм реакций циклооксигеназы и липоксигеназы показан здесь.
Полиненасыщенная жирная кислота метаболизирует в основном двумя путями: циклооксигеназным и липоксигеназным, активность которых в разных клетках выражена в разной степени. Циклооксигеназный путь отвечает за синтез простагландинов и тромбоксанов, липоксигеназный – за синтез лейкотриенов.
Лекарственная регуляция синтеза
Гормоны коры надпочечников глюкокортикоиды опосредованно, через синтез специфических белков, подавляют активность фосфолипазы А2 и, следовательно, образование всех типов эйкозаноидов. На этом основано широкое использование препаратов кортизола (преднизолон, дексаметазон) для лечения воспалительных, аутоиммунных и аллергических состояний.
Нестероидные противовоспалительные средства (аспирин, индометацин, ибупрофен) ингибируют циклооксигеназу и снижают выработку простагландинов и тромбоксанов. Они нашли применение как противовоспалительные, жаропонижающие и анальгезирующие средства, и в кардиологии для профилактики тромбозов (аспирин).
NB! Блокирование циклооксигеназы в почках, как побочный эффект салицилатов, вызывает уменьшение синтеза простагландинов в почечных сосудах и снижение кровообращения в почках.
NB! В зависимости от исходной жирной кислоты и, соответственно, числа двойных связей все эйкозаноиды делят на три группы:
Первая группа – синтезируется из эйкозотриеновой кислоты (С20:3), которая образуется из линоленовой (С18:3). В соответствии с количеством двойных связей простагландинам и тромбоксанам присваивается индекс 1, лейкотриенам – индекс 3: например, Pg E1, Pg I1, Tx A1, Lt A3.
Интересно, что PgE1 ингибирует аденилатциклазу в жировой ткани и препятствует липолизу, также он участвует в патогенезе бронхоспазма.
Вторая группа синтезируется из арахидоновой кислоты (С20:4). По тому же правилу ей присваивается индекс 2 или 4, например, Pg E2, Pg I2, Tx A2, Lt A4.
Третья группа эйкозаноидов происходит из тимнодоновой кислоты (С20:5). По числу двойных связей присваиваются индексы 3 или 5: например, Pg E3, Pg I3, Tx A3, Lt A5.
Подразделение эйкозаноидов на группы имеет клиническое значение. Особенно ярко это проявляется на примере простациклинов и тромбоксанов:
| Исходная жирная кислота | Число двойных связей в молекуле | Активность простациклинов | Активность тромбоксанов |
| Линоленовая, С18:3 | 1 |  |
 |
| Арахидоновая, С20:4 | 2 | ||
| Тимнодоновая, С20:5 | 3 |
Результирующим эффектом пищевого приема или фармакологического применения более полиненасыщенных жирных кислот является образование тромбоксанов и простациклинов с большим числом двойных связей, что изменяет реологические свойства крови и снижает ее вязкость, понижает тромбообразование, расширяет мелкие сосуды и улучшает кровоснабжение тканей, снижает повышенное артериальное давление. Все эти эффекты ценны при нарушениях кровообращения, при атеросклерозе, у кардиологических больных.
У фосфолипидов преобладает структурная функция
Фосфолипиды (ФЛ, фосфатиды) представляют собой соединение спирта глицерола или сфингозина с высшими жирными кислотами и фосфорной кислотой. В их состав также входят азотсодержащие соединения холин (витамин B4), этаноламин, серин, циклический шестиатомный спирт инозитол (витамин В8).
Пищевые источники фосфолипидов
Доля фосфолипидов в пищевом жире невелика (не более 10%), это фосфолипиды клеточных мембран и жировых эмульсий. Источниками фосфолипидов является практически любой жир, используемый в пищу – любые растительные масла, свиной, говяжий и другой животный жир, жир молочных продуктов и сливочное масло. В результате фосфолипидов поступает около 8-10 г в сутки.
В организме человека наиболее распространены глицерофосфолипиды.
Глицерофосфолипиды
Жирные кислоты, входящие в состав этих фосфолипидов, неравноценны. Ко второму атому углерода присоединена, как правило, полиненасыщенная жирная кислота. При углероде С1 находятся любые кислоты, чаще мононенасыщеннные или насыщенные.
Наиболее простым глицерофосфолипидом является фосфатидная кислота (ФК) – промежуточное соединение для синтеза ТАГ и ФЛ.
Фосфатидилсерин (ФС), фосфатидилэтаноламин (ФЭА, кефалин), фосфатидилхолин (ФХ, лецитин) – структурные ФЛ, они вместе с холестерином формируют липидный бислой клеточных мембран, обеспечивают активность мембранных ферментов, вязкость и проницаемость мембран.
NB! Кроме этого, дипальмитоил-фосфатидилхолин, являясь поверхностно-активным веществом, служит основным компонентом сурфактанта легочных альвеол. Его недостаток в легких недоношенных младенцев приводит к развитию синдрома дыхательной недостаточности.
Также фосфатидилхолин, являясь одним из важнейших компонентов желчи, поддерживает находящийся в ней холестерин в растворенном состоянии и, таким образом, препятствует образованию желчных камней.
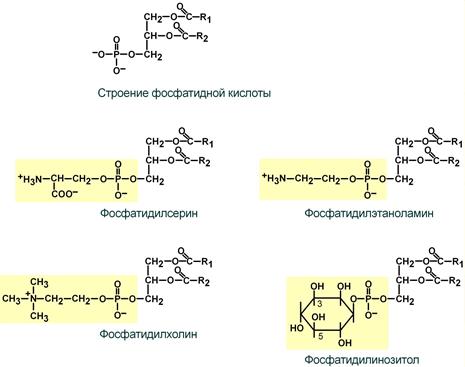
Cтроение преобладающих в организме фосфолипидов
Фосфатидилинозитол (ФИ) – играет ведущую роль в кальций-фосфолипидном механизме передачи гормонального сигнала в клетку.
Лизофосфолипиды – продукт гидролиза фосфолипидов фосфолипазой А2, образуются при определенных стимулах, вызывающих в клетке синтез эйкозаноидов (простагландинов, лейкотриенов).
Гораздо более редким является кардиолипин – структурный фосфолипид в мембране митохондрий.
Плазмалогены при С1 содержат высший спирт вместо жирной кислоты. Они участвуют в построении структуры мембран, составляют до 10% фосфолипидов мозга и мышечной ткани.
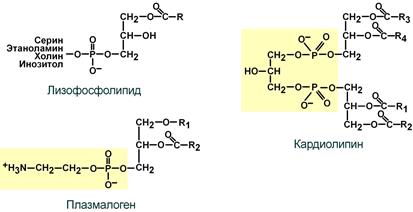
Строение менее распространенных фосфолипидов
Сфингофосфолипиды
Основным представителем у человека являются сфингомиелины – основное их количество расположено в сером и белом веществе головного и спинного мозга, в оболочке аксонов периферической нервной системы, есть в печени, почках, эритроцитах и других тканях. В качестве жирных кислот выступают насыщенные и мононенасыщенные, которые присоединены к спирту сфингозину.
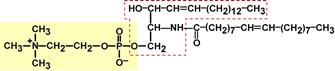
Строение сфингомиелина, содержащего олеиновую кислоту
(сфингозин обведен красной рамкой)
В нервной ткани сфингомиелин участвует в передаче нервного сигнала по аксонам, активно изучается роль сфинголипидов в регуляции внутриклеточных процессов в качестве источника вторичного мессенджера церамида.
Гликолипиды - рецепторные молекулы
Гликолипиды широко представлены в нервной ткани и мозге. Размещаются они в наружном монослое плазматических мембран, при этом олигосахаридные цепи направлены наружу. Роль гликолипидов изучена еще недостаточно: они обладают рецепторной функцией, участвуют в межклеточных взаимодействиях и контактах, являются антигенами клеточной поверхности (группы крови Lewis и AB0).
Строение гликолипидов
Общей частью всех гликолипидов является церамид – соединение аминоспирта сфингозина с длинноцепочечной жирной кислотой.
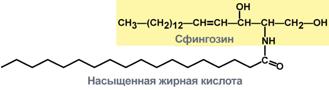
Строение церамида
В классе гликолипидов выделяют две группы — цереброзиды и ганглиозиды. В составе обеих групп находится церамид и углевод, представленный моно- или олигосахаридом или их производными.

Общее строение гликолипидов
Большую часть гликолипидов составляют цереброзиды. Для большинства тканей более характерны глюкозилцерамиды, однако в нервной ткани главным цереброзидом является галактозилцерамид.
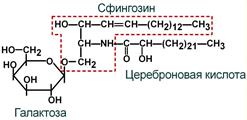
Строение галактозилцерамида
Другой группой гликолипидов являются широко представленные в нервной ткани ганглиозиды. Они содержат церамид, разные остатки моносахаров и их производных (сульфосахаров и аминосахаров) и одну или несколько молекул сиаловых кислот.
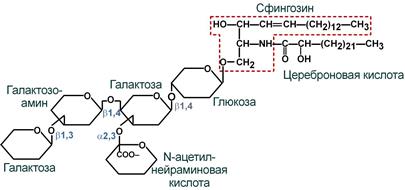
Схематичное строение ганглиозида
Болезни накопления липидов называются липидозы
Генетические заболевания, при которых происходит неполное расщепление полимерных веществ и их накопление, получили название лизосомные болезни накопления, так как они обусловлены дефектами специфических лизосомальных гидролаз. В случае накопления липидов такие болезни называются липидозы. При липидозах нарушается нормальный катаболизм липидов до соответствующих мономеров.
Липидозы
Болезнь Вольмана – редкое аутосомно-рецессивное заболевание из-за дефекта кислой эстеразы лизосом, что обусловливает накопление эфиров холестерола в лизосомах печени, селезенки, надпочечников, костного мозга и тонкого кишечника. Проявляется в первые недели жизни рвотой, диареей и стеатореей, гепатоспленомегалией и двусторонним кальцинозом надпочечников. Больные умирают в возрасте до 6 мес.
Болезнь Шюллера-Кристиана, аутосомно-рецессивное заболевание, характеризуется отложением в плоских костях, твердой мозговой оболочке и коже холестерола и его эфиров. Характерными являются деструктивные изменения в костях, остеопороз, мозжечковые расстройства. Заболевание обычно начинается в возрасте до 10 лет, реже позднее. Мужчины болеют в 2 раза чаще, чем женщины. Течение заболевания прогрессирующее. Дефектный фермент неизвестен.
Болезнь Гоше – отложение цереброзидов в макрофагальных клетках селезенки, печени, лимфатических узлов и костного мозга. Возникает в связи с аутосомно-рецессивным отсутствием гликоцереброзидазы (β-глюкозидазы). Основными симптомами заболевания являются спленомегалия, увеличение печени и селезенки, а также изменения в костях, проявляющиеся в виде остеопороза.

Дефектный фермент при болезни Гоше
При болезни Нимана-Пика наблюдается отложение сфингомиелина в клетках различных органов из-за дефицита сфингомиелиназы. Болезнь наследуется аутосомно-рецессивно, проявляется резким увеличением печени и селезенки, замедлением психического развития ребенка, появлением слепоты и глухоты. Чаще всего дети погибают в возрасте до 2 лет.

Дефектный фермент при болезни Нимана-Пика
Болезнь Тея-Сакса (амавротическая семейная идиотия) является результатом дефекта N-ацетилгексозаминидазы, при котором происходит отложение ганглиозидов в клетках головного мозга, что сопровождается атрофией зрительных нервов, слепотой, слабоумием и смертью в младенческом возрасте.
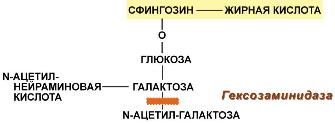
Дефектный фермент при болезни Тея-Сакса
Триацилглицеролы - это запас энергии
Триацилглицеролы (ТАГ, триглицериды, триацилглицерины, нейтральные жиры) являются наиболее распространенными липидами в организме человека. В среднем их доля составляет 16-23% от массы тела взрослого.
Функции триацилглицеролов
- резервно-энергетическая – у среднего человека запасов подкожного жира хватает на поддержание жизнедеятельности в течение 40 дней полного голодания,
- в составе подкожной и брыжеечной жировой ткани механическая защита тела и внутренних органов.
- теплосберегающая – за счет толщины подкожного жира,
В состав ТАГ входит трехатомный спирт глицерол и три жирные кислоты. Жирные кислоты преобладают насыщенные (пальмитиновая, стеариновая) и мононенасыщенные (пальмитолеиновая, олеиновая). По строению можно выделить простые и смешанные ТАГ. В простых ТАГ все жирные кислоты одинаковые, например, трипальмитилглицерол, тристеарилглицерол. В смешанных ТАГ жирные кислоты отличаются, например, дипальмитилстеарилглицерол, пальмитилолеилстеарилглицерол..
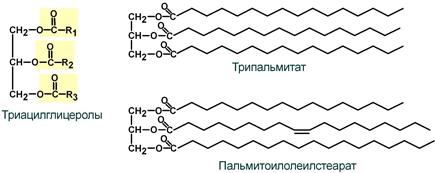
Строение триацилглицеролов
Пищевые источники
Триацилглицеролы преобладают в практически любом жире, используемом в пищу – любые растительные масла, свиной, говяжий и другой животный жир, жир молочных продуктов и сливочное масло.
Суточная потребность в нейтральных жирах принята на уровне 80-100 г, растительных масел должно быть около 30% (но не менее 20 г) от общего количества жира. Однако в связи с изменением образа жизни в развитых странах (переедание, гиподинамия) в последние годы появилась тенденция к пересмотру рекомендуемых величин потребления ТАГ в сторону снижения – до 30-40 г/сут.
Прогоркание жиров
Прогоркание жиров – это бытовое определение широко распространенного в природе явления. Выделяют два типа прогоркания:
- биологическое – начинается с бактериального гидролиза ТАГ и накопления свободных жирных кислот. Их дальнейшее ферментативное окисление приводит к накоплению короткоцепочечных жирных кислот, β-кетокислот, гидроксикислот, эпоксидов, альдегидов и кетонов, которые и являются причиной изменения вкуса и запаха пищевого жира.
- химическое (перекисное окисление липидов, ПОЛ) – результат окисления жиров под действием О2 воздуха или под действием активных форм кислорода с образованием гидроперекисей (L-OOH), вторичных и третичных продуктов ПОЛ (малоновый диальдегид, диеновые конъюгаты).
В организме перекисному окислению противодействуют антиоксидантные системы, включающие витамины Е, А, С, трипептид глутатион, разнообразные белки и ферменты (каталаза, пероксидаза, супероксиддисмутаза).
Холестерол жизненно необходим клеткам
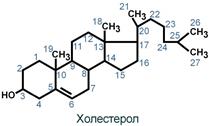
Холестерол относится к группе соединений, имеющих в своей основе циклопентан-пергидрофенантреновое кольцо, и является ненасыщенным спиртом.
Примерно 1/4 часть всего холестерола в организме этерифицирована олеиновой кислотой и полиненасыщенными жирными кислотами. В плазме крови соотношение эфиров холестерола к свободному холестеролу составляет 2:1.
Источники
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, при этом половина образуется в печени, около 15% в кишечнике, оставшаяся часть в любых клетках, не утративших ядро. Таким образом, все клетки организма способны синтезировать холестерол.
Из пищевых продуктов наиболее богаты холестеролом (в пересчете на 100 г продукта) сметана (0,002 г), сливочное масло (0,03 г), яйца (0,18 г), говяжья печень (0,44 г). В целом за сутки с обычным рационом поступает около 0,4 г.
Выведение из организма
Выведение холестерола из организма происходит в основном через кишечник:
- с фекалиями в виде холестерола, поступающего с желчью, и образованных микрофлорой нейтральных стеролов (до 0,5 г/сут),
- в виде желчных кислот (до 0,5 г/сут),
- около 0,1 г удаляется в составе слущивающегося эпителия кожи и кожного сала,
- примерно 0,1 г превращается в стероидные гормоны (женские и мужские половые гормоны, глюкокортикоиды, минералокортикоиды) и после их деградации выводится с мочой.
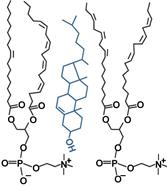
Уплотняющая роль холестерина в клеточных мембранах
Функции холестерола
1. Структурная – входит в состав мембран, повышая их вязкость и жесткость.
2. Связывание полиненасыщенных жирных кислот и их транспорт между органами и тканями в составе липопротеинов низкой и высокой плотности.
3. Является предшественником желчных кислот, стероидных гормонов (кортизола, альдостерона, половых гормонов) и витамина D.
Переваривание жиров включает 5 этапов
Потребность в липидах взрослого организма составляет 80-100 г в сутки, из них растительных (жидких) жиров должно быть не менее 30%. С пищей в основном поступают триацилглицеролы, фосфолипиды и эфиры ХС.
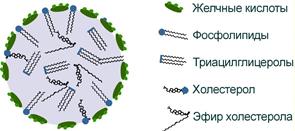
Строение капли эмульгированного жира
Переваривание липидов осложняется тем, что их молекулы полностью или частично гидрофобны.Для преодоления этой помехи используется процесс эмульгирования, когда гидрофобные молекулы (ТАГ, эфиры ХС) или гидрофобные части молекул (жирные кислоты в составе ФЛ, циклическая структура ХС) погружаются внутрь мицеллы, а гидрофильные остаются на поверхности, обращенной к водной фазе.
Условно внешний обмен липидов можно подразделить на следующие этапы:
1. Эмульгирование жиров пищи – необходимо для того, чтобы ферменты ЖКТ смогли начать работу.
2. Гидролиз триацилглицеролов, фосфолипидов и эфиров ХС под влиянием ферментов ЖКТ.
3. Образование мицелл из продуктов переваривания (жирных кислот, МАГ, холестерола).
4. Всасывание образованных мицелл в эпителий кишечника.
5. Ресинтез триацилглицеролов, фосфолипидов и эфиров ХС в энтероцитах.
После ресинтеза липидов в кишечнике они собираются в транспортные формы – хиломикроны (в основном) и липопротеины высокой плотности (ЛПВП) (малое количество) – и разносятся по организму.
Переваривание жиров идет в кишечнике
Эмульгирование и гидролиз липидов
Первые два этапа переваривания липидов, эмульгирование и гидролиз, происходят практически одновременно. Вместе с этим, продукты гидролиза не удаляются, а оставаясь в составе липидных капелек, облегчают дальнейшее эмульгирование и работу ферментов.
Переваривание в ротовой полости
У взрослых в ротовой полости переваривание липидов не идет, хотя длительное пережевывание пищи способствует частичному эмульгированию жиров.
Переваривание в желудке
Собственная липаза желудка у взрослого не играет существенной роли в переваривании липидов из-за ее небольшого количества и того, что ее оптимум рН 4,5-5,5. Также влияет отсутствие эмульгированных жиров в обычной пище (кроме молока).
Тем не менее, у взрослых теплая среда и перистальтика желудка вызывает некоторое эмульгирование жиров. При этом даже низко активная липаза расщепляет незначительные количества жира, что важно для дальнейшего переваривания жиров в кишечнике, т.к. наличие хотя бы минимального количества свободных жирных кислот облегчает эмульгирование жиров в двенадцатиперстной кишке и стимулирует секрецию панкреатической липазы.
Переваривание в кишечнике
Под влиянием перистальтики ЖКТ и составных компонентов желчи пищевой жир эмульгируется. Образующиеся при переваривании лизофосфолипиды также являются хорошим поверхностно-активным веществом, поэтому они способствуют дальнейшему эмульгированию пищевых жиров и образованию мицелл. Размер капель такой жировой эмульсии не превышает 0,5 мкм.
Гидролиз эфиров ХС осуществляет холестерол-эстераза панкреатического сока.
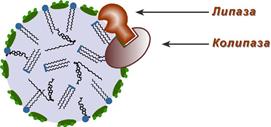
Роль колипазы в действии липазы
Переваривание ТАГ в кишечнике осуществляется под воздействием панкреатической липазы с оптимумом рН 8,0-9,0. В кишечник она поступает в виде пролипазы, для проявления ее активности требуется колипаза, которая помогает липазе расположиться на поверхности липидной капли.
Колипаза, в свою очередь, активируется трипсином и затем образует с липазой комплекс в соотношении 1:1. Панкреатическая липаза отщепляет жирные кислоты, связанные с С1 и С3 атомами углерода глицерола. В результате ее работы остаются 2-моноацилглицеролы (2-МАГ), которые всасываются в составе мицелл или превращаются моноглицерол-изомеразой в 1-МАГ. Последний гидролизуется до глицерола и жирной кислоты. Примерно 3/4 ТАГ после гидролиза остаются в форме 2-МАГ и только 1/4 часть ТАГ гидролизуется полностью.
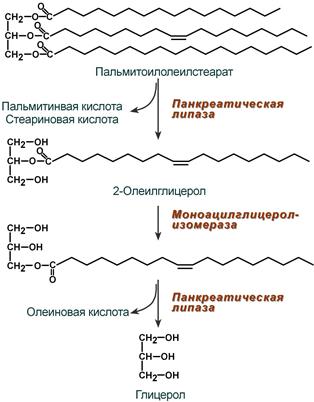
Полный ферментативный гидролиз триацилглицерола
В панкреатическом соке также имеется активируемая трипсином фосфолипаза А2, отщепляющая в фосфолипидах жирную кислоту от С2, также обнаружена активность фосфолипазы С и лизофосфолипазы.
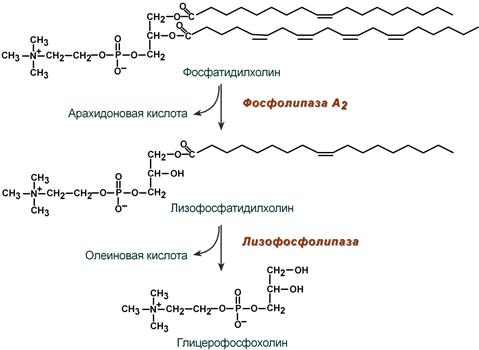
Действие фосфолипазы А2 и лизофосфолипазы на примере фосфатидилхолина
В кишечном соке также имеется активность фосфолипазы А2 и фосфолипазы С.
NB! Для работы всех указанных гидролитических ферментов в кишечнике необходимы ионы Са2+, способствующие удалению жирных кислот из зоны катализа.
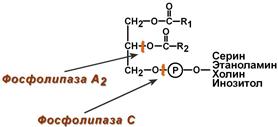
Точки действия фосфолипаз
Образование мицелл
В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, свободные жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер уже около 5 нм). Свободный глицерол всасывается напрямую в кровь.
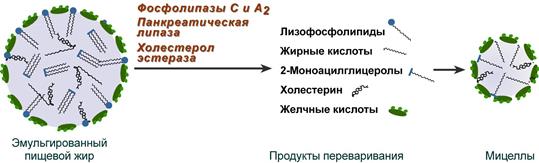
Схематичное изображение переваривания липидов
Полученные смешанные мицеллы достигают эпителия кишечника и их компоненты диффундируют в клетки и попадают в гладкую эндоплазматическую сеть. Желчные кислоты почти не всасываются и остаются в просвете кишечника. Далее желчные кислоты достигают подвздошной кишки и всасываются там (Кишечно-печеночная циркуляция).
Без желчи липиды не переварятся
Желчь представляет собой сложную жидкость со щелочной реакцией. В ней выделяют сухой остаток – около 3% и воду – 97%. В сухом остатке обнаруживается две группы веществ:
- попавшие сюда путем фильтрации из крови натрий, калий, бикарбонат-ионы (HCO3¯), креатинин, холестерол (ХС), фосфатидилхолин (ФХ),
- активно секретируемые гепатоцитами билирубин и желчные кислоты.
В норме между основными компонентами желчи Желчные кислоты : Фосфатидилхолин : Холестерин выдерживается соотношение равное 65 : 12 : 5.
В сутки образуется около 10 мл желчи на кг массы тела, таким образом, у взрослого человека это составляет 500-700 мл. Желчеобразование идет непрерывно, хотя интенсивность на протяжении суток резко колеблется.
Роль желчи
1. Наряду с панкреатическим соком нейтрализация кислого химуса, поступающего из желудка. При этом ионы HCO3¯ взаимодействуют с НСl, выделяется углекислый газ и происходит разрыхление химуса, что облегчает переваривание.
2. Обеспечивает переваривание жиров:
- эмульгирование для последующего воздействия липазой, необходима комбинация [желчные кислоты+жирные кислоты+моноацилглицеролы],
- уменьшает поверхностное натяжение, что препятствует сливанию капель жира,
- образование мицелл, способных всасываться.
3. Благодаря п.п.1 и 2 обеспечивает всасывание жирорастворимых витаминов (витамин A, витамин D, витамин K, витамин E).
4. Усиливает перистальтику кишечника.
5. Экскреция избытка ХС, желчных пигментов, креатинина, металлов Zn, Cu, Hg, лекарств. Для холестерина желчь – единственный путь выведения, с ней может выводиться 1-2 г/сут.
NB! Формирование желчи (холерез) идет непрерывно, не прекращаясь даже при голодании. Усиление холереза происходит под влиянием n.vagus и при приеме мясной и жирной пищи. Снижение – под влиянием симпатической нервной системы и повышения гидростатического давления в желчных путях.
Желчевыделение (холекинез) обеспечено низким давлением в двенадцатиперстной кишке, усиливается под влиянием n.vagus и ослабляется симпатической нервной системой. Сокращение желчного пузыря стимулируется бомбезином, секретином, инсулином и холецистокинин—панкреозимином. Расслабление вызывают глюкагон и кальцитонин.
Синтез желчных кислот
Образование желчных кислот идет в эндоплазматическом ретикулуме при участии цитохрома Р450, кислорода, НАДФН и аскорбиновой кислоты. 75% холестерина, образуемого в печени, участвует в синтезе желчных кислот.
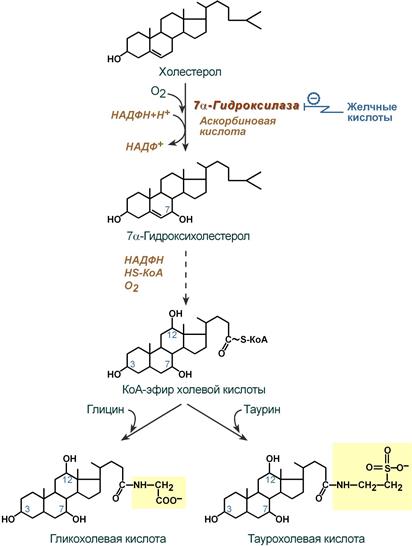
Реакции синтеза желчных кислот на примере холевой кислоты
В печени синтезируются первичные желчные кислоты:
- холевая (3α, 7β, 12α, гидроксилирована по С3, С7, С12),
- хенодезоксихолевая (3α, 7α, гидроксилирована по С3, С7).
Затем они образуют парные желчные киcлоты – конъюгаты с глицином (гликопроизводные) и с таурином (тауропроизводные), в соотношении 3:1 соответственно.
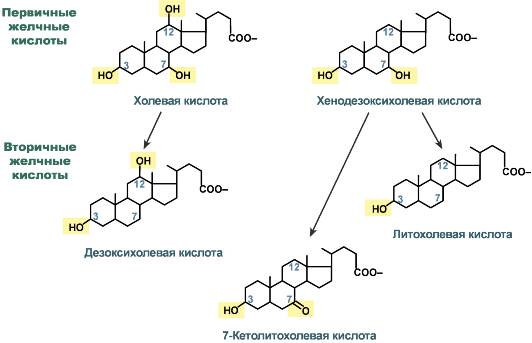
Строение желчных кислот
В кишечнике под действием микрофлоры эти желчные кислоты теряют OH-группу при С7 и превращаются во вторичные желчные кислоты:
- холевая в дезоксихолевую (3α, 12α, гидроксилирована по С3 и С12),
- хенодезоксихолевая в литохолевую (3α, гидроксилирована только по С3) и 7-кетолитохолевую (7α-ОН-группа преобразуется в кетогруппу) кислоты.
Также выделяют третичные желчные кислоты. К ним относятся
- образованная из литохолевой кислоты (3α) – сульфолитохолевая (сульфонирование по C3),
- образованная из 7-кетолитохолевой кислоты (3α, 7-кето) при восстановлении 7-кетогруппы до ОН-группы – урсодезоксихолевая (3α, 7β).
Регуляция синтеза
Регуляторным ферментом является 7α-гидроксилаза. Имеются два способа регуляции
- Коваалентная модификация путем фосфорилирования-дефосфорилирования. Глюкагон, по аденилатциклазному механизму, ведет к фосфорилированию и активации фермента. инсулин оказывает противоположный эффект.
- Генетическая регуляция, т.е. изменение количества фермента:
- она может быть гормональной: тиреоидные гормоны индуцируют транскрипцию и повышают синтез фермента, эстрогены репрессируют и подавляют синтез этого фермента.
- при участии метаболитов: холестерол увеличивает, а желчные кислоты снижают синтез фермента.
Кишечно-печеночная циркуляция
Циркуляция желчных кислот заключается в их непрерывном движении из гепатоцитов в просвет кишечника и реабсорбция большей части желчных кислот в подвздошной кишке, что сберегает ресурсы холестерола. В сутки происходит 6-10 таких циклов. Таким образом, небольшое количество желчных кислот (всего 3-5 г) обеспечивает переваривание липидов, поступающих в течение суток. Потери в размере около 0,5 г/сут соответствуют суточному синтезу холестерола de novo.
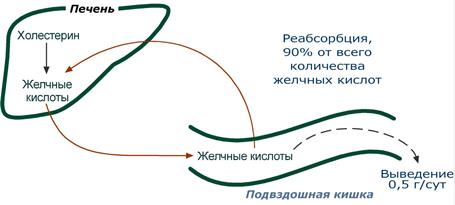
Кишечно-печеночная рециркуляция желчных кислот
В стенке кишечника происходит ресинтез жира
Всасывание липидов
После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника в начальные 100 см. В норме всасывается 98% пищевых липидов.
1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь без каких-либо особенных механизмов. Этот процесс важен для грудных детей, т.к. молоко содержит в основном коротко- и среднецепочечные жирные кислоты. Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (длинноцепочечные жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Их размеры в 100 раз меньше самых мелких эмульгированных жировых капелек. Через водную фазу мицеллы мигрируют к щеточной каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты диффундируют внутрь клетки, после чего транспортируются в эндоплазматический ретикулум.
Желчные кислоты также здесь могут попадать в энтероциты и далее уходить в кровь воротной вены, однако бóльшая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
Ресинтез липидов в энтероцитах
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, одновременно могут использоваться и эндогенные жирные кислоты, поэтому ресинтезированные жиры отличаются от пищевых и более близки по составу к «своим» жирам. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это, во-первых, ликвидирует их детергентное действие на мембраны и, во-вторых, создает их транспортные формы для переноса по крови в ткани.
Активация жирной кислоты
Поступившая в энтероцит (как и в любую другую клетку) жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
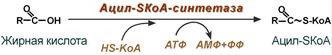
Реакция активации жирной кислоты
Ресинтез эфиров холестерола
Холестерол этерифицируется с использованием ацил-SКоА и фермента ацил-SКоА:холестерол-ацилтрансферазы (АХАТ).
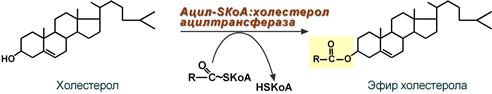
Реакция ресинтеза эфиров холестерола
Ресинтез триацилглицеролов
Для ресинтеза ТАГ есть два пути:
Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ.
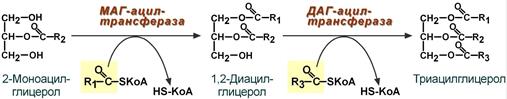
Моноацилглицеридный путь образования ТАГ
Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется, а глицерол в энтероцитах не задерживается и быстро переходит в кровь, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы. Здесь можно выделить следующие реакции:
- Образование глицерол-3-фосфата из глюкозы.
- Превращение глицерол-3-фосфата в фосфатидную кислоту.
- Превращение фосфатидной кислоты в 1,2-ДАГ.
- Синтез ТАГ.
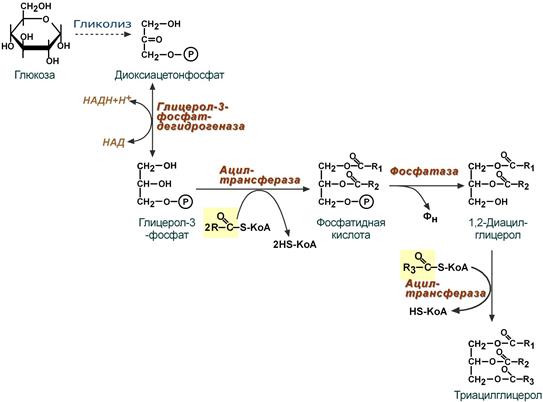
Глицеролфосфатный путь образования ТАГ
Ресинтез фосфолипидов
Фосфолипиды синтезируются также, как и в остальных клетках организма (см «Cинтез фосфолипидов«). Для этого есть два способа:
Первый путь – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина.
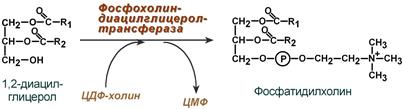
Ресинтез фосфолипидов из ДАГ на примере фосфатидилхолина
Второй путь – на основе синтезируемой in situ фосфатидной кислоты.
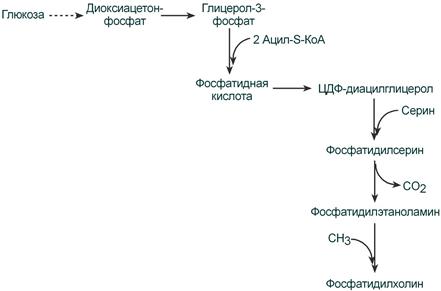
Схема ресинтеза фосфолипидов из фосфатидной кислоты
Переваривание липидов может легко нарушиться
Любое нарушение внешнего обмена липидов (проблемы переваривания или всасывания) проявляется увеличением содержания жира в кале – развивается стеаторея.
Причины нарушений переваривания липидов
1. Снижение желчеобразования в результате недостаточного синтеза желчных кислот и фосфолипидов при болезнях печени, гиповитаминозах.
2. Снижение желчевыделения (обтурационная желтуха, билиарный цирроз, желчнокаменная болезнь). У детей часто причиной может быть перегиб желчного пузыря, который сохраняется и во взрослом состоянии.
3. Снижение переваривания при недостатке панкреатической липазы, который возникает при заболеваниях поджелудочной железы (острый и хронический панкреатит, острый некроз, склероз). Может возникать относительная недостаточность фермента при сниженном выделении желчи.
4. Избыток в пище катионов кальция и магния, которые связывают жирные кислоты, переводят их в нерастворимое состояние и препятствуют их всасыванию. Эти ионы также связывают желчные кислоты, нарушая их работу.
5. Снижение всасывания при повреждении стенки кишечника токсинами, антибиотиками (неомицин, хлортетрациклин).
6. Недостаточность синтеза пищеварительных ферментов и ферментов ресинтеза липидов в энтероцитах при белковой и витаминной недостаточности.
Нарушение желчевыделения
Нарушение желчеобразования и желчевыделения чаще всего связаны с хроническим избытком ХС в организме вообще и в желчи в частности, так как желчь является единственным способом его выведения.
Избыток ХС в печени возникает при увеличении количества исходного материала для его синтеза (ацетил-SКоА) и при недостаточном синтезе желчных кислот из-за снижения активности 7α-гидроксилазы (гиповитаминозы С и РР).
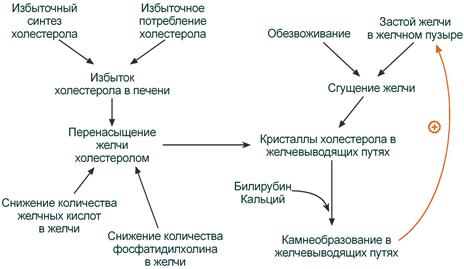
Причины нарушения формирования желчи и возникновения холелитиаза
Избыток ХС в желчи может быть абсолютным в результате избыточного синтеза и потребления или относительным. Так как соотношение желчных кислот, фосфолипидов и холестерола должно составлять 65:12:5, то относительный избыток холестерина возникает при недостаточном синтезе желчных кислот (гиповитаминозы С, В3, В5) и/или фосфатидилхолина (недостаток полиненасыщенных жирных кислот, витаминов В6, В9, В12). В результате нарушения соотношения образуется желчь, из которой холестерол, как плохо растворимое соединение, кристаллизуется. Далее к кристаллам присоединяются ионы кальция и билирубин, что сопровождается образованием желчных камней.
Застой в желчном пузыре, возникающий при неправильном питании, приводит к сгущению желчи из-за реабсорбции воды. Недостаточное потребление воды или длительный прием мочегонных средств (лекарства, кофеин-содержащие напитки, этанол) существенно усугубляет эту проблему.
У детей свои причуды
Особенности переваривания жира у детей
У младенцев клетками слизистой корня языка и глотки (железы Эбнера) при сосании секретируется лингвальная липаза, продолжающая свое действие и в желудке.
У грудных младенцев и детей младшего возраста липаза желудка более активна, чем у взрослых, так как кислотность в желудке детей около 5,0. Помогает и то, что жиры молока эмульгированы. Жиры у младенцев дополнительно перевариваются за счет липазы женского молока, в коровьем молоке липаза отсутствует. Благодаря таким преимуществам у детей грудного возраста в желудке происходит 25-50% всего липолиза.
В двенадцатиперстной кишке гидролиз жира дополнительно осуществляется панкреатической липазой. До 7 лет активность панкреатической липазы невысока, что ограничивает способности ребенка к перевариванию пищевого жира, ее активность достигает максимума только к 8-9 годам. Но, тем не менее, это не мешает ребенку уже в первые месяцы жизни гидролизовать почти 100% пищевого жира и иметь 95% всасывания.
В грудном возрасте содержание желчных кислот в желчи постепенно увеличивается примерно в три раза, позднее этот рост замедляется.
Обмен ТАГ и ФЛ - это обмен жирных кислот
Судьба жирной кислоты зависит от ее строения (насыщенная ЖК или полиненасыщенная ЖК) и от внутриклеточных условий (наличие или отсутствие энергии в клетке).
Абсорбтивный период
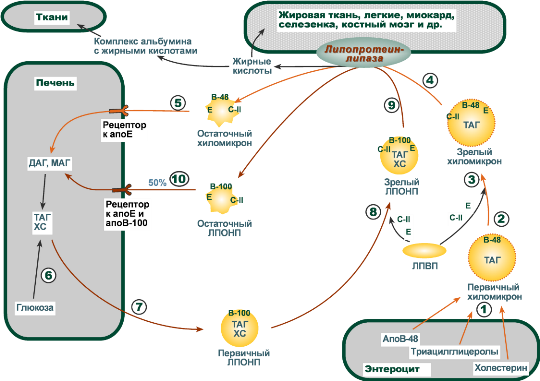
В течение нескольких часов после приема пищи (абсорбтивный период) экзогенныенасыщенные и мононенасыщенные жирные кислоты поступают с помощью хиломикронов от кишечника в ткани, которые имеют липопротеинлипазу на эндотелии капилляров (подробнее).
Параллельно в этот период времени в печени жирные кислоты способны синтезироваться из избытка экзогенной глюкозы. Далее эти эндогенные жирные кислоты этерифицируются с глицеролом в реакциях липогенеза с образованием ТАГ. Потом они транспортируются из печени в ткани, имеющие липопротеинлипазу, в составе ЛПОНП.
В клетках жировой ткани после приема пищи насыщенная жирная кислота либо синтезируется из глюкозы, либо поступает сюда из хиломикронов и ЛПОНП. Далее она направляется в липогенез и запасается в составе ТАГ.
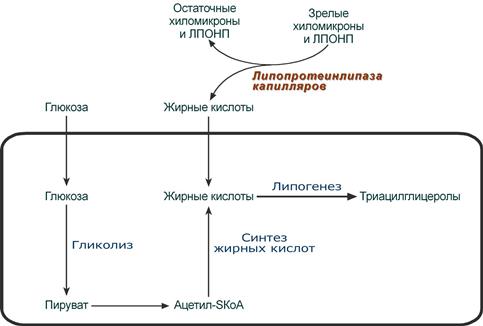
Возможные источники и пути использования жирной кислоты в абсорбтивный период
(на примере адипоцита)
Если липопротеинлипазы нет в ткани, то жирная кислота доставляется сюда в комплексе с альбумином. Этот комплекс образуется после работы липопротеинлипазы в других тканях.
NB! Из плазмы крови внутрь клеток насыщенные жирные кислоты переносятся при участи транспортных «белков, связывающих жирные кислоты» (fatty acid binding protein, FABP). Эти белки составляют большое семейство для переноса липофильных веществ, включая эйкозаноиды и ретиноиды. Также некоторые члены семейства транспортируют липофильные молекулы от внешней клеточной мембраны к их внутриклеточным рецепторам.
Полиненасыщенные жирные кислоты (ПНЖК) обычно проникают в клетки в составе эфиров холестерола и фосфолипидов в составе ЛПВП и ЛПНП (подробнее). Эти жирные кислоты необходимы для синтеза эйкозаноидов в некоторых видах клеток, либо они участвуют в синтезе фосфолипидов для клеточных мембран.
Голодание и мышечная работа
При голодании хиломикроны и ЛПОНП в крови отсутствуют. Так как данному состоянию обычно сопутствует гипогликемия, то для ее компенсации из поджелудочной железы секретируется глюкагон. Под влиянием глюкагона и других гормонов в жировых депо активируется расщепление ТАГ до жирных кислот и глицерола (липолиз). Транспорт жирных кислот, вышедших в кровь, осуществляется альбумином.
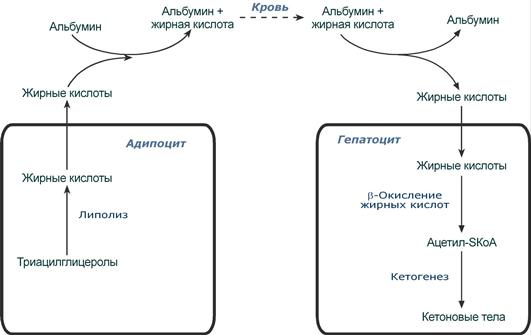
Источник и путь использования жирной кислоты при длительном голодании
(на примере гепатоцита и адипоцита)
При физической работе гормоны адреналин, соматотропин и глюкокортикоиды вызывают в адипоцитах липолиз и выход жирных кислот в кровь. В комплексе с альбумином эти кислоты доставляются, главным образом, в мышцу для обеспечения мышечного сокращения.
В состоянии покоя, когда процессы пищеварения уже закончились, при краткосрочном и длительном голодании, при физической нагрузке в большинстве клеток, кроме нейронов и эритроцитов, жирные кислоты сгорают в процессах β-окисления и ЦТК, обеспечивая 50% и более всей энергии клетки.
В печени при длительном голодании (более 20 часов) жирные кислоты направляются в кетогенез на синтез кетоновых тел. Кетоновые тела далее разносятся по организму, преобразуются в клетках в ацетил-SКоА и используются для их основного энергетического обеспечения.
Триацилглицеролы нужны при работе
Синтезируясь во время и сразу после приема пищи (липогенез) и запасаясь в жировой ткани, триацилглицеролы являются формой хранения насыщенных и мононенасыщенных жирных кислот. Распад триацилглицеролов (триглицеридов) по-другому называется липолиз или мобилизация жира. Он идет в жировых клетках постоянно и обычно существует равновесие между синтезом и распадом ТАГ.
Даже в состоянии покоя организма печень, сердце, скелетные мышцы и другие ткани (кроме эритроцитов и нейроцитов) более 50% энергии получают из окисления жирных кислот, поступающих из жировой ткани благодаря фоновому липолизу. По мере уменьшения резервов глюкозы клетки все больше энергии получают из окисления жирных кислот. Таким образом, насыщенные жирные кислоты выполняют роль своеобразного буфера энергии в организме.
Мобилизация триацилглицеролов и окисление жирных кислот активируется
- при нормальных физиологических стрессовых ситуациях – эмоциональный стресс, мышечная работа, голодание,
- при патологических состояниях – сахарный диабет I типа, другие гормональные заболевания (гиперкортицизм, гипертиреоз).
В результате стимулированного липолиза в адипоцитах образуются свободный глицерол и жирные кислоты.
Глицерол с кровью доставляется в печень и почки, здесь фосфорилируется и окисляется в метаболит гликолиза диоксиацетонфосфат. В зависимости от условий диоксиацетонфосфат может включаться в реакции глюконеогенеза (при голодании, мышечной нагрузке) или окисляться в реакциях гликолиза.
Жирные кислоты транспортируются в крови в комплексе с альбуминами плазмы:
- при физической нагрузке – в мышцы,
- в обычных условиях и при голодании – в мышцы и большинство тканей, однако при этом около 30% жирных кислот захватывается печенью.
При голодании и физической нагрузке после проникновения в клетки жирные кислоты вступают на путь β-окисления.
Общая характеристика мобилизации ТАГ
В целом мобилизацию жира можно представить как последовательность следующих событий:
- Липолиз – гормонзависимый распад ТАГ в жировой ткани или резервных ТАГ в самой клетке.
- Транспорт жирных кислот из жировой ткани по крови в комплексе с альбумином.
- Проникновение жирной кислоты в цитозоль клетки-мишени.
- Активация жирной кислоты через присоединение HS-КоА.
- Карнитин-зависимое перемещение жирной кислоты в митохондрию.
- Окисление жирной кислоты с образованием ацетильных групп (в форме ацетил-SКоА).
- Сгорание ацетил-SКоА в цикле лимонной кислоты или синтез (только в печени) кетоновых тел.
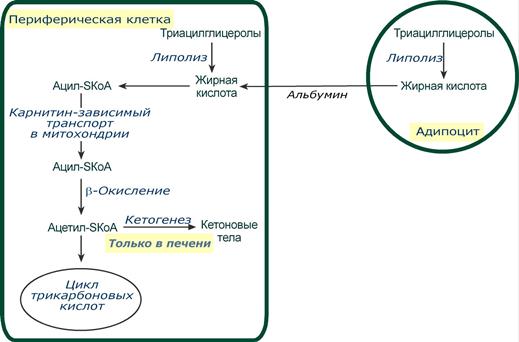
Общая схема мобилизации ТАГ и использования жирных кислот
Активность липазы зависит от гормонов
Первое, что происходит при использовании нейтрального жира во время голодания и физической нагрузки – это активация ферментов, отвечающих за отщепление жирных кислот от триацилглицерола. Первый активируемый фермент называется триацилглицерол-липаза или ТАГ-липаза.
NB! В настоящее время существует современная, другая концепция регуляции ферментов, отвечающих за мобилизацию триацилглицеролов в клетках. Согласно этой теории гормон-чувствительной на самом деле является HSL-липаза (hormone-sensitive lipase, здесь ДАГ-липаза), а не ТАГ-липаза.
На данной странице изложена еще принятая, но устарешая, схема регуляции липолиза.
Кроме ТАГ-липазы, в адипоцитах имеются еще диацилглицерол-липаза ( ДАГ-липаза) и моноацилглицерол-липаза (МАГ-липаза), которые постоянно активны, однако в покое их активность не проявляется из-за отсутствия субстрата. Как только в клетке после работы ТАГ-липазы появляются диацилглицеролы, начинает работать постоянно активная ДАГ-липаза, продукт ее реакции моноацилглицерол (МАГ) является субстратом для МАГ-липазы. Образующиеся жирные кислоты и глицерол покидают клетку.
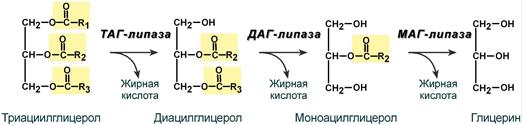
Гидролиз триацилглицеролов липазами жировой клетки
Для регуляции активности ТАГ-липазы обязательно наличие гормонального влияния (адреналин, глюкагон, соматотропин, инсулин и ряд других гормонов).
Активация триацилглицерол-липазы
Гормонзависимая активация липолиза в адипоцитах адреналином и глюкагоном происходит при напряжении организма (голодание, длительная мышечная работа, охлаждение). Активность ТАГ-липазы зависит, главным образом, от соотношения инсулин / глюкагон.
В целом последовательность событий активации липолиза по данной схеме выглядит следующим образом:
- Молекула гормона (адреналин, глюкагон, АКТГ) взаимодействует со своим рецептором.
- Активный гормон-рецепторный комплекс воздействует на мембранный G-белок.
- G-белок активирует фермент аденилатциклазу.
- Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный посредник (мессенджер).
- цАМФ аллостерически активирует фермент протеинкиназу А.
- Протеинкиназа А фосфорилирует ТАГ-липазу и активирует ее.
- ТАГ-липаза отщепляет от триацилглицеролов жирную кислоту в 1 или 3 положении с образованием диацилглицерола (ДАГ).
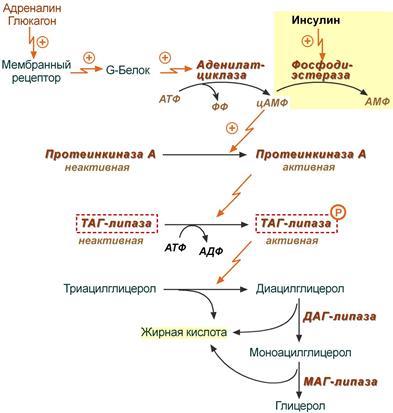
Каскадный механизм активации ТАГ-липазы
Кроме гормонов, влияющих на активность аденилатциклазы через G-белки, существуют иные механизмы активации. Например, соматотропный гормон увеличивает количество аденилатциклазы, глюкокортикоиды индуцируют синтез ТАГ-липазы.
Снижение активности ТАГ-липазы
Инсулин препятствует активации липолиза другими гормонами, т.к.
- он активирует фермент фосфодиэстеразу, которая гидролизует цАМФ, что останавливает каскадную активацию ТАГ-липазы,
- активирует протеинфосфатазы, дефосфорилирующие ТАГ-липазу .
Для окисления жирных кислот существует свой путь
Окисление жирных кислот (β-окисление)
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты.
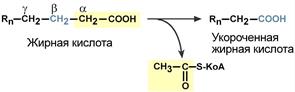
Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом:
Пальмитоил-SКоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН
Этапы окисления жирных кислот
1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.

Реакция активации жирной кислоты
2. Ацил-SКоА не способен проходить через митохондриальную мембрану, поэтому существует способ переноса жирной кислоты в комплексе с витаминоподобным веществом карнитином (витамин В11). На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I.
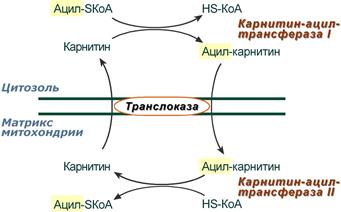
Карнитин-зависимый транспорт жирных кислот в митохондрию
3. После связывания с карнитином жирная кислота переносится через внутреннюю митохондриальную мембрану транслоказой. На внутренней стороне этой мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-SКоА, который вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА. К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.
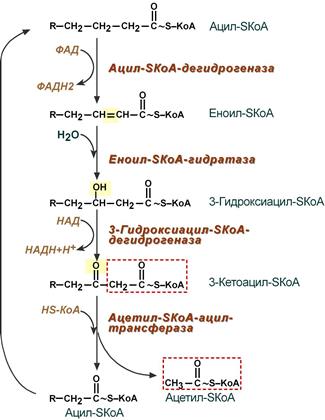
Последовательность реакций β-окисления жирных кислот
Расчет энергетического баланса β-окисления
NB! Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH2 – 2,0.
По современным данным значение коэффициента P/O для НАДH соответствует 2,5, для ФАДH2 – 1,5.
При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
- количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2.
- число циклов β-окисления. Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте.
- число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН2 не образуется. Количество недополученных ФАДН2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений.
- количество энергии АТФ, потраченной на активацию (всегда соответствует двум макроэргическим связям).
Пример. Окисление пальмитиновой кислоты
- Так как имеется 16 атомов углерода, то при β-окислении образуется 8 молекул ацетил-SКоА. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН (7,5 АТФ), 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула ГТФ, что эквивалентно 10 молекулам АТФ. Итак, 8 молекул ацетил-SКоА обеспечат образование 8×10=80 молекул АТФ.
- Для пальмитиновой кислоты число циклов β-окисления равно 7. В каждом цикле образуется 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула НАДН (2,5 АТФ). Поступая в дыхательную цепь, в сумме они «дадут» 4 молекулы АТФ. Таким образом, в 7 циклах образуется 7×4=28 молекул АТФ.
- Двойных связей в пальмитиновой кислоте нет.
- На активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ.
- Таким образом, суммируя, получаем 80+28-2 =106 молекул АТФ образуется при окислении пальмитиновой кислоты.
Окисление ненасыщенных жирных кислот
При окислении ненасыщенных жирных кислот необходимы дополнительные ферменты изомеразы. Эти изомеразы перемещают двойные связи в жирнокислотных остатках из γ— в β—положение и переводят природные двойные связи из цис— в транс-положение.
Таким образом, уже имеющаяся двойная связь готовится к β-окислению и пропускается первая реакция цикла, в которой участвует ФАД.
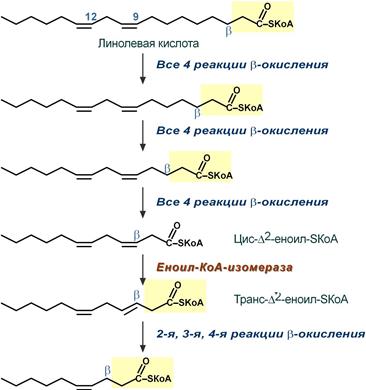
Первые реакции окисления ненасыщенных жирных кислот и роль изомераз
Расчет энергетического баланса β-окисления ненасыщенной жирной кислоты
NB! Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH2 – 2,0.
По современным данным значение коэффициента P/O для НАДH соот-ветствует 2,5, для ФАДH2 – 1,5.
При расчете количества АТФ, образуемого при β-окислении ненасыщенных жирных кислот необходимо учитывать:
- количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2.
- число циклов β-окисления. Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте.
- число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН2 не образуется. Количество необразованных ФАДН2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений.
- количество энергии АТФ, потраченной на активацию (всегда соответствует двум макроэргическим связям).
Пример. Окисление линолевой кислоты
- Так как число атомов углерода равно 18, то количество молекул ацетил-S-КоА равно 9. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН (7,5 АТФ), 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула ГТФ, что эквивалентно 10 молекулам АТФ. Итак, 9 молекул ацетил-SКоА обеспечат образование 9×10=90 молекул АТФ.
- Исходя из формулы (n/2 — 1) число циклов β-окисления равно 8. В каждом цикле образуется 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула НАДН (2,5 АТФ). Поступая в дыхательную цепь, в сумме они «дадут» 4 молекулы АТФ. При расчете получаем 8×4=32 молекулы АТФ.
- В кислоте имеются 2 двойные связи. Следовательно, в двух циклах β-окисления не образуется 2 молекулы ФАДН2, что равноценно потере 3 молекул АТФ.
- На активацию жирной кислоты тратятся 2 макроэргические связи.
- Таким образом, энергетический выход 90 + 32 – 3 – 2 =117 молекул АТФ.
Окисление "нечетных" жирных кислот требует еще двух витаминов
Жирные кислоты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой образуется пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и образованию сукцинил-SКоА. В этих реакциях участвуют биотин (витамин H) и 5-дезоксиаденозилкобаламин (витамин В12).
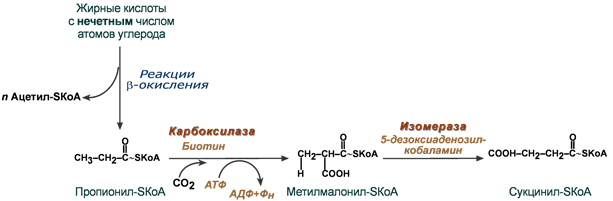
Последние реакции окисления жирных кислот с нечетным числом атомов углерода
Расчет энергетического баланса β-окисления нечетной жирной кислоты
NB! Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH2 – 2,0.
По современным данным значение коэффициента P/O для НАДH соответствует 2,5, для ФАДH2 – 1,5.
При расчете количества АТФ, образуемого при β-окислении нечетных жирных кислот необходимо:
- принять в качестве числа углеродов в нечетной кислоте выражение 2n + 3,
- посчитать количество образуемого ацетил-SКоА – определяется соответственно как n,
- найти число циклов β-окисления – соответствует числу ацетил-SKoA — n,
- учитывать карбоксилирование пропионил-SКоА в метилмалонил-SКоА – затрачивается одна макроэргическая связь АТФ,
- образованный в итоге сукцинил-SКоА, являясь метаболитом ЦТК, последовательно превращается в сукцинат, фумарат, малат и оксалоацетат с образованием ГТФ, ФАДН2 и НАДН,
- оксалоацетат, не выходя из ЦТК, сгорает в двух полных циклах до 4 молекул CO2,
- количество энергии АТФ, потраченной на активацию жирной кислоты (всегда соответствует двум макроэргическим связям).
Пример. Окисление нонадециловой кислоты
- Число атомов углерода равно 19. Таким образом, выражению 2n + 3 соответствует 16 + 3.
- Исходя из n количество молекул ацетил-S-КоА равно 8. Значит при его окислении в ЦТК образуется 8 × 10=80 молекул АТФ.
- Исходя из n число циклов β-окисления равно 8. При расчете получаем 8 × 4=32 молекул АТФ.
- На пути от сукцинил-S-КоА до оксалоацетата образуется 1 АТФ (от 1 ГТФ) + 1,5 АТФ (от ФАДН2) + 2,5 АТФ (от НАДН) = 5 молекул АТФ.
- При полном окислении оксалоацетата в двух оборотах ЦТК образуется 10 × 2 = 20 молекул АТФ
- На карбоксилирование пропионил-SКоА и на активацию жирной кислоты тратятся 3 макроэргические связи.
- Таким образом, энергетический выход 80 + 32 + 5 + 20 — 3 =134 молекулы АТФ.
Кетоновые тела - это способ транспорта ацетильной группы
При состояниях, сопровождающихся снижением глюкозы крови, клетки органов и тканей испытывают энергетический голод. Так как окисление жирных кислот процесс «трудоемкий», а нервные клетки вообще неспособны окислять жирные кислоты, то печень облегчает использование этих кислот тканями, заранее окисляя их до уксусной кислоты и переводя последнюю в транспортную форму – кетоновые тела.
К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон.
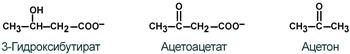
Строение кетоновых тел
Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. Как уже указывалось, при состояниях, активирующих липолиз в жировой ткани, не менее 30% образованных жирных кислот задерживаются печенью. К таким состояниям относится голодание, сахарный диабет I типа, длительные физические нагрузки. Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с образованием кетоновых тел.
Кроме отмеченных ситуаций, количество кетоновых тел в крови возрастает при алкогольном отравлении и потреблении жирной пищи. При богатой жирами диете, особенно у детей, жирные кислоты не успевают включиться в состав ТАГ и ЛПОНП и частично переходят в митохондрии, что увеличивает синтез кетоновых тел. При алкогольном отравлении субстратом для синтеза кетонов является ацетил-SКоА, синтезируемый при обезвреживании этанола.
В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот.
NB! Для детей раннего возраста характерна неустойчивость жирового обмена, связанная с недостаточностью регуляторного влияния ЦНС и эндокринной системы. Поэтому кетонемия и кетонурия у грудных детей наблюдается чаще, чем у взрослых.
Уровень ацетоацетата быстро нарастает между 12 и 24 часами жизни и сохраняется высоким первую неделю жизни, что свидетельствует об активной мобилизации жира из депо, высокой утилизации свободных жирных кислот в печени и малом использовании кетоновых тел в тканях.
У детей до 7 лет под влиянием различных стимулов (краткое голодание, инфекции, эмоциональное возбуждение) ускоряется синтез кетоновых тел и может легко возникать кетоацидоз, сопровождающийся неукротимой рвотой («ацетонемическая рвота«). Причиной этого служит неустойчивость углеводного обмена и малые запасы гликогена у детей, что усиливает липолиз в адипоцитах, накопление жирных кислот в крови и, следовательно, кетогенез в печени.
Синтез кетоновых тел (кетогенез)
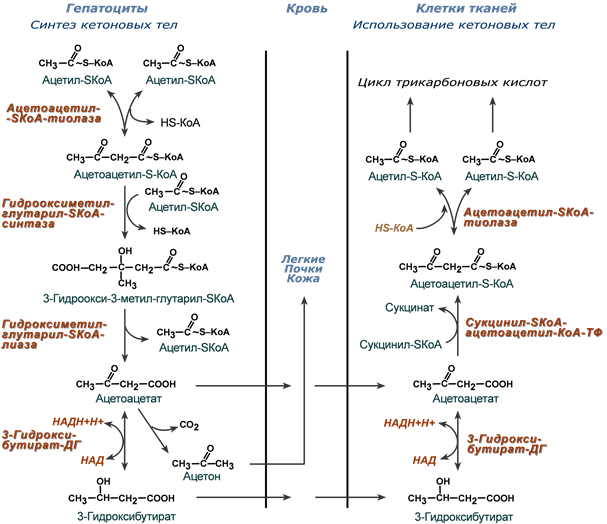
Реакции синтеза и утилизации кетоновых тел
Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников.
В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
NB! При сахарном диабете 1 типа (инсулинзависимом) в гепатоците глюкозы может быть много, т.к. глюкоза проникает в него через ГлюТ-2 без участия инсулина. Однако, точно также как при голодании, соотношение инсулин/глюкагон низкое, и оксалоацетат очень активно уходит на синтез глюкозы, что тормозит ЦТК и отправляет ацетил-SKoA на образование кетоновых тел.
При сахарном диабете 2 типа (инсулиннезависимом) инсулина достаточно и соотношение инсулин/глюкагон велико, поэтому глюконеогенез не активен и оксалоацетата хватает для поддержания ЦТК. Образуемый здесь ацетил-SKoA либо сгорает в ЦТК, либо используется для реакций синтеза холестерина и синтеза жирных кислот (которые стимулируются инсулином). К тому же при наличии инсулина попадающие в печень жирные кислоты будут не окисляться, а вовлекаться в синтез триацилглицеролов и ЛПОНП.
Жиры синтезируются при избытке глюкозы
Реакции биосинтеза липидов могут идти в гладкой эндоплазматической сети клеток всех органов. Субстратом для синтеза жиров de novo является глюкоза.
Как известно, попадая в клетку, глюкоза превращается в гликоген, пентозы и окисляется до пировиноградной кислоты. При высоком поступлении глюкоза используется для синтеза гликогена, но этот вариант ограничивается объемом клетки. Поэтому глюкоза «проваливается» в гликолиз и превращается в пируват либо напрямую, либо через пентозофосфатный шунт. Во втором случае образуется НАДФН, который понадобится впоследствии для синтеза жирных кислот.
Пируват переходит в митохондрии, декарбоксилируется в ацетил-SКоА и вступает в ЦТК. Однако в состоянии покоя, при отдыхе, при наличии избыточного количества энергии в клетке реакции ЦТК (в частности, изоцитратдегидрогеназная реакция) блокируются избытком АТФ и НАДН.
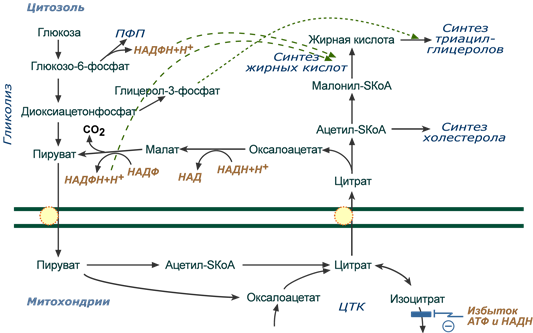
Общая схема биосинтеза триацилглицеролов и холестерола из глюкозы
В результате накапливается первый метаболит ЦТК – цитрат. По градиенту концентрации он перемещается в цитозоль, расщепляется с образованием ацетил-SКоА, который далее используется в биосинтезе холестерола и жирных кислот.
Оксалоацетат, также образуемый из цитрата, восстанавливается малатдегидрогеназой до яблочной кислоты и возвращается в митохондрии
- посредством малат-аспартатного челночного механизма (на рисунке не показан),
- после декарбоксилирования малата до пирувата НАДФ-зависимым малик-ферментом. Образованный НАДФН будет использован при синтезе жирных кислот или холестерина.
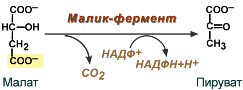
Реакция малик-фермента
Путь синтеза жирных кислот длиннее, чем их окисление
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды.
Условно можно выделить 4 этапа биосинтеза:
1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот.
2. Перенос ацетил-SКоА из митохондрий в цитозоль:
- может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении,
- обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК.
Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА.
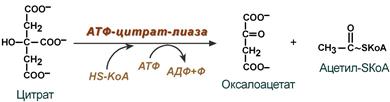
Образование ацетил-SКоА из лимонной кислоты
Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом («яблочный» фермент).
3. Образование малонил-SКоА из ацетил-SКоА.
Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.
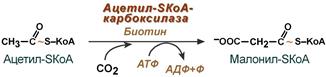
Образование малонил-SКоА из ацетил-SКоА
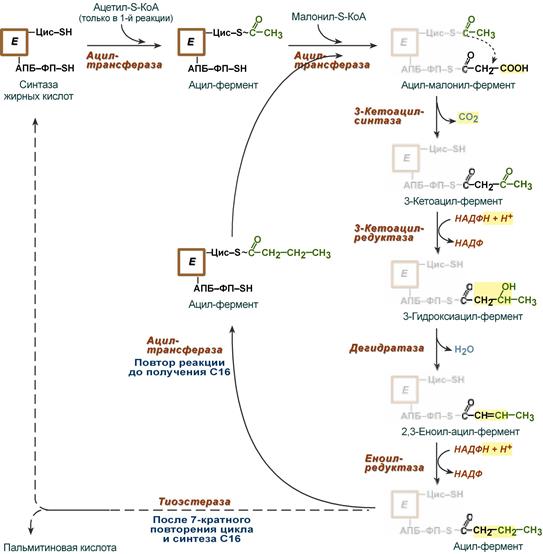
4. Синтез пальмитиновой кислоты.
Осуществляется мультиферментным комплексом «синтаза жирных кислот» (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ).
Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН.
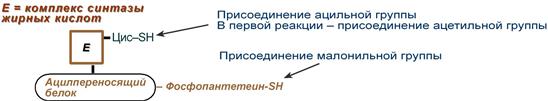
Активные группы синтазы жирных кислот
В первых двух трансферазных реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы.
3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы в виде CO2.
Далее 3-кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином.
Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину АПБ присоединяется малонил-SКоА и цикл повторяется 7 раз. В первом цикле синтеза получается 4-углеродная (масляная) кислота, во втором — 6-углеродная (капроновая), и так далее до образования остатка пальмитиновой кислоты C16. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой.
Реакции синтеза жирных кислот
Удлинение цепи жирных кислот
Синтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20. Присоединение углеродов идет по карбоксильной группе (С1).
Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С20). Но двойная связь животными клетками вводится не далее 9 атома углерода, поэтому ω3- и ω6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников. Например, арахидоновая кислота может образоваться в клетке только при наличии γ-линоленовой или линолевой кислот. При этом линолевая кислота (18:2, Δ9,12) дегидрируется до γ-линоленовой (18:3, Δ6,9,12) и удлиняется до эйкозотриеновой кислоты (20:3, Δ8,11,14), последняя далее вновь дегидрируется до арахидоновой кислоты (20:4, Δ5,8,11,14). Так формируются жирные кислоты ω6-ряда.
Для образования жирных кислот ω3-ряда, например, тимнодоновой, необходимо наличие α-линоленовой кислоты (18:3, Δ9,12,15), которая дегидрируется (18:4, Δ6,9,12,15), удлиняется (20:4, Δ8,11,14,17) и опять дегидрируется с получением тимнодоновой кислоты (20:5, Δ5,8,11,14,17).
Обмен жирных кислот регулируется
Гормональная регуляция
Синтез и окисление триацилглицеролов и жирных кислот зависит от соотношения инсулин / глюкагон.
1. Изменение количества ферментов
Ферменты комплекса пальмитатсинтазы и ацетил-SКоА-карбоксилазы являются адаптивными ферментами, количество их возрастает при усиленном питании и уменьшается при голодании и потреблении жира. Индуктором биосинтеза этих ферментов является инсулин.
2. Ковалентная модификация
Благодаря инсулину, глюкагону, адреналину, тиреотропному и адренокортикотропному гормонам происходит ковалентная модификация ферментов ацетил-SКоА-карбоксилазы и ТАГ-липазы путем фосфорилирования-дефосфорилирования.
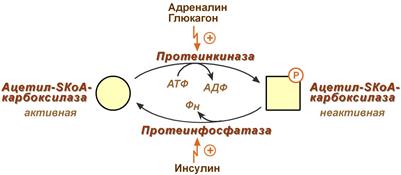
Регуляция активности ацетил-SКоА-карбоксилазы
Инсулин активирует протеинфосфатазу и способствует дефосфорилированию и активации ацетил-SКоА-карбоксилазы. Одновременно в клетке дефосфорилируется и инактивируется ТАГ-липаза.
Глюкагон, адреналин или другие гормоны, действуя по аденилатциклазному механизму с участием цАМФ-зависимой протеинкиназы, вызывают фосфорилирование и ингибирование ацетил-SКоА-карбоксилазы и, следовательно, останавливают липогенез. Одновременно они активируют ТАГ-липазу.
При уменьшении количества инсулина и возрастании глюкагона усиливаются липолиз в жировой ткани, поступление жирных кислот в печень и другие ткани и реакции их β-окисления. Такое состояние наблюдается при гипогликемии любого происхождения. При обратном соотношении гормонов начинаются реакции синтеза жиров.
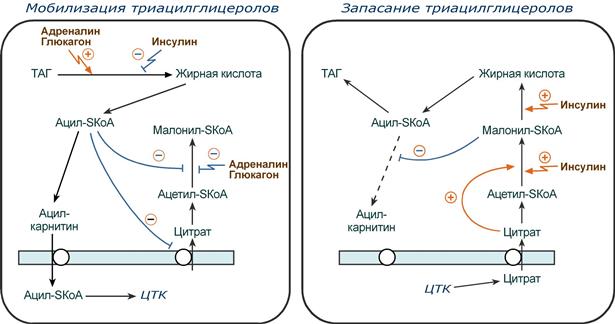
Способы регуляции реакций обмена триацилглицеролов
Метаболическая регуляция
В регуляции синтеза и окисления жирных кислот играют роль три участка:
1. Активность ацетил-SКоА-карбоксилазы регулируется:
- цитратом – аллостерический активатор фермента, накапливается в цитозоле при избыточном количестве энергии,
- ацил-SКоА по принципу обратной отрицательной связи ингибирует фермент, препятствуя синтезу малонил-SКоА. Т.е. если ацил-SКоА не успевает вступить в этерификацию или усиливается липолиз в клетке или увеличивается поступление жирных кислот извне, то автоматически блокируется синтез новых жирных кислот.
2. Транспорт цитрата из митохондрии в цитозоль подавляется избытком ацил-SКоА, это снижает синтез жирных кислот.
3. Карнитин-ацилтрансфераза ингибируется при образовании малонил-SКоА, что останавливает поступление ацил-SКоА внутрь митохондрий и снижает β-окисление.
Таким образом, когда в клетке имеется избыток энергии, то усиление синтеза жирных кислот достигается поступлением в цитозоль цитрата и при наличии малонил-S-КоА. Полученные молекулы ацил-SКоА быстро поступают на этерификацию глицерола до ТАГ и не накапливаются в цитозоле.
Если в клетке недостаточно энергии, то необходимо активировать β-окисление жирных кислот для ее получения. В этом случае гормональные влияния вызывают липолиз (или поступление жирных кислот извне) и накопление ацил-SКоА в цитозоле, что автоматически (см пункт 2) через уменьшение количества цитрата и малонил-SКоА препятствует синтезу новых жирных кислот. Параллельно (см пункт 3) убыль малонил-SКоА и активация карнитин-ацил-трансферазы запускает β-окисление.
Синтез фосфолипидов и триацилглицеролов тесно связаны
Начальные реакции синтеза триацилглицеролов и фосфолипидов совпадают и происходят при наличии глицерола и жирных кислот.
В реакциях биосинтеза можно выделить следующие события:
1. Образование глицерол-3-фосфата через диоксиацетонфосфат из глюкозы или при фосфорилировании свободного глицерола.
2.. Биосинтез фосфатидной кислоты – требует наличия глицерол-3-фосфата и жирных кислот. При связывании глицерол-3-фосфата с жирными кислотами синтезируется фосфатидная кислота.
Далее фосфатидная кислота может превращаться двумя путями – в ЦДФ-ДАГ или дефосфорилироваться до 1,2-ДАГ.
3. Синтез триацилглицерола (липогенез) – идет из 1,2-ДАГ после дефосфорилирования фосфатидной кислоты. Образованный 1,2-ДАГ ацилируется до ТАГ.
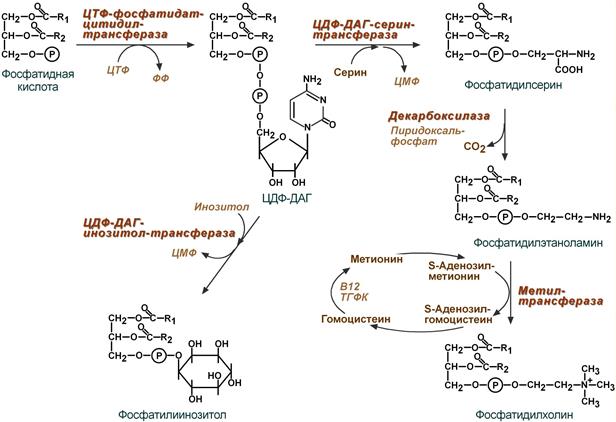
4. Синтез фосфолипидов. Сейчас рассматриваются два пути синтеза фосфолипидов.
- По одному пути 1,2-ДАГ не превращается в ТАГ, а связывается с этаноламином с образованием фосфатидилэтаноламина, либо с холином – образуется фосфатидилхолин.
- По другому пути, ЦДФ-ДАГ связывается либо с инозитолом, либо с серином с образованием соответственно фосфатидилинозитола или фосфатидилсерина. При декарбоксилировании фосфатидилсерина далее образуется фосфатидилэтаноламин, который может превратиться, в свою очередь, в фосфатидилхолин.
Синтезированный любым способом фосфатидилэтаноламин также способен взаимодействовать с серином и обратно образовывать фосфатидилсерин.
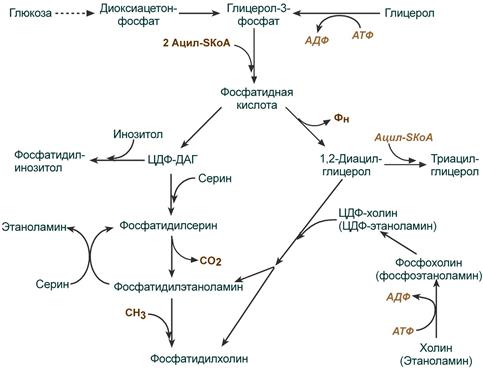
Общая схема реакций синтеза триацилглицеролов и фосфолипидов
ЦДФ-ДАГ, являясь активной формой фосфатидной кислоты, способен превращаться не только в фосфатидилинозитол, фосфатидилсерин, но и в другие фосфолипиды, например в кардиолипин.
Начальные реакции синтеза ТАГ и ФЛ совпадают
Образование глицерол-3-фосфата
В начале всего процесса происходит образование глицерол-3-фосфата.
В абсорбтивный период поступающий в печень из кишечника глицерол фосфорилируется глицеролкиназой. В мышцах, жировой ткани и других тканях глицеролкиназа отсутствует, поэтому здесь глицерол-3-фосфат образуется из диоксиацетонфосфата, метаболита гликолиза. В печени этот второй путь используется тоже.
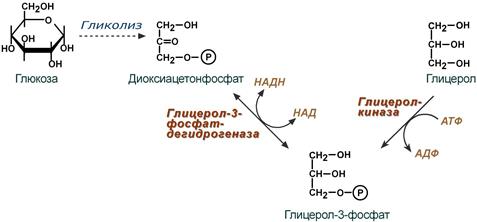
Реакции синтеза глицерол-3-фосфата
Синтез фосфатидной кислоты
Жирные кислоты, поступающие из крови при распаде ХМ, ЛПОНП или синтезированные в клетке из глюкозы, также должны активироваться. Они превращаются в ацил-SКоА в АТФ-зависимой реакции.

Реакция активации жирной кислоты
При наличии глицерол-3-фосфата и ацил-SКоА синтезируется фосфатидная кислота.
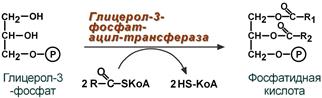
Реакция синтеза фосфатидной кислоты
В зависимости от вида жирной кислоты, образующаяся фосфатидная кислота может содержать насыщенные или ненасыщенные жирные кислоты. Несколько упрощая ситуацию, можно отметить, что жирнокислотный состав фосфатидной кислоты определяет ее дальнейшую судьбу:
- если используются насыщенные и мононенасыщенные кислоты (пальмитиновая, стеариновая, пальмитолеиновая, олеиновая), то фосфатидная кислота направляется на синтез ТАГ,
- при включении полиненасыщенных жирных кислот (линоленовая, арахидоновая, кислоты ω3-ряда) фосфатидная кислота является предшественником фосфолипидов.
Синтез ТАГ - это запасание энергии
Липогенез
Синтез триацилглицеролов (липогенез) заключается в дефосфорилировании фосфатидной кислоты, полученной из глицерол-3-фосфата, и присоединении ацильной группы.
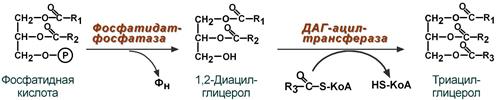
Реакции синтеза ТАГ из фосфатидной кислоты
Если синтез ТАГ происходил в печени, то они эвакуируются из нее в ткани, имеющие на эндотелии своих капилляров липопротеинлипазу (транспорт ТАГ в крови). Транспортной формой служат ЛПОНП. Строго говоря, клеткам организма нужны только жирные кислоты, все остальные компоненты ЛПОНП не являются необходимыми.
Синтез ТАГ увеличивается при соблюдении хотя бы одного из следующих условий, которые обеспечивают появление избытка ацетил-SКоА:
- наличие источника «дешевой» энергии. Например,
1) диета богатая простыми углеводами (глюкоза, сахароза). При этом концентрация глюкозы в печени и адипоцитах после еды резко повышается, она окисляется до ацетил-SКоА и под влиянием инсулина в этих органах активно происходит синтез жиров.
2) наличие этанола, высокоэнергетичного соединения, который окисляется до ацетил-SКоА. «Алкогольный» ацетил используется в печени для синтеза жира при условии нормального питания. Примером может служить «пивное ожирение». - повышение концентрации жирных кислот в крови. Например, при усиленном липолизе в жировых клетках под воздействием каких-либо веществ (фармпрепараты, кофеин и т.п.), при эмоциональном стрессе и отсутствии (!) мышечной активности увеличивается поток жирных кислот в гепатоциты. Здесь в результате происходит интенсивный синтез ТАГ.
- высокие концентрации инсулина и низкие концентрации глюкагона – после приема высокоуглеводной и жирной пищи.
Для синтеза фосфолипидов нужны липотропные факторы
Синтез фосфолипидов
Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов ФЛ – фосфатидной кислоты или холина и этаноламина.
1 путь – «спасательный»
Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активация холина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях.
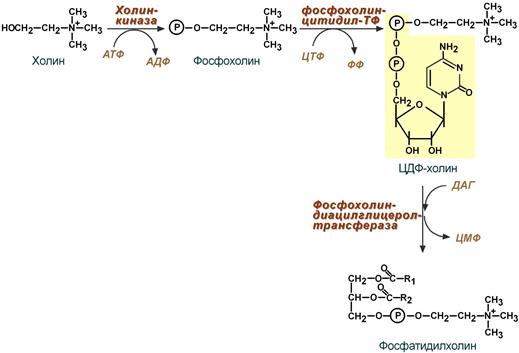
Реакции синтеза фосфолипидов
с использованием 1,2-ДАГ на примере фосфатидилхолина
2 путь – основной, синтез de novo
Здесь холин (или этаноламин) не встраиваются в готовом виде, а образуются уже в молекуле фосфолипида.
Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин.
Реакции синтеза фосфолипидов
с использованием фосфатидной кислоты
3 путь – обратное превращение
Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина.
Липотропные вещества
Все вещества, способствующие синтезу ФЛ и препятствующие синтезу ТАГ, и способные предотращать жировую инфильтрацию печени, называются липотропными факторами. К ним относятся:
1. Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин.
2. Метионин – в виде S-аденозилметионина является донором метильных групп для синтеза холина и фосфатидилхолина.
3. Витамины:
- пиридоксин (В6), способствующий образованию ФЭА из ФС.
- цианкобаламин (В12) и фолиевая кислота, участвующие в реакциях обмена серина, глицина и метионина при ресинтезе метионина из гомоцистеина. Следовательно они, хотя и не напрямую, но необходимы для синтеза фосфатидилхолина.
Транспорт липидов - отдельная задача
Поскольку липиды являются в основе своей гидрофобными молекулами, то они транспортируются в водной фазе крови в составе особых частиц – липопротеинов.
Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется скорлупа и ядро. «Скорлупа» липопротеина является гидрофильной, ядро – гидрофобное.
- поверхностный гидрофильный слой формируют фосфолипиды (их полярная часть), холестерол (его ОН-группа), белки. Гидрофильность липидов поверхностного слоя призвана обеспечить растворимость липопротеиновой частицы в плазме крови,
- «ядро» формируют неполярные эфиры холестерола (ХС) и триацилглицеролы (ТАГ), которые и являются транспортируемыми жирами. Их соотношение колеблется в разных типах липопротеинов. Также к центру обращены жирнокислотные остатки фосфолипидов и циклическая часть холестерола.
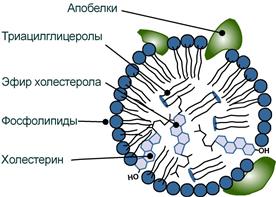
Схема строения любого транспортного липопротеина
Выделяют четыре основных класса липопротеинов:
- липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП),
- липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП),
- липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП),
- хиломикроны (ХМ).
Свойства и функции липопротеинов разных классов зависят от их состава, т.е. от вида присутствующих белков и от соотношения триацилглицеролов, холестерола и его эфиров, фосфолипидов.
Подробно состав липопротеинов описан здесь
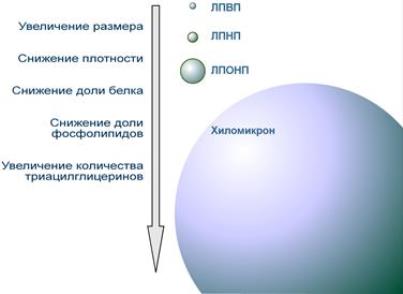
Cравнение размера и состава липопротеинов
Функции липопротеинов
Функциями липопротеинов крови являются
1. Перенос к клеткам тканей и органов
- насыщенных и мононенасыщенных жирных кислот в составе триацилглицеролов для последующего депонирования или использования в качестве энергетических субстратов,
- полиненасыщенных жирных кислот в составе эфиров холестерола для использования клетками в синтезе фосфолипидов или образования эйкозаноидов,
- холестерола в качестве мембранного материала,
- фосфолипидов в качестве мембранного материала,
Хиломикроны и ЛПОНП ответственны, в первую очередь, за транспорт жирных кислот в составе ТАГ. Липопротеины высокой и низкой плотности – за транспорт свободного холестерола и жирных кислот в составе его эфиров. ЛПВП способны также отдавать клеткам часть своей фосфолипидной оболочки.
2. Удаление избытка холестерола с мембран клеток.
3. Транспорт жирорастворимых витаминов.
4. Перенос стероидных гормонов (наряду со специфическими транспортными белками).
Апобелки липопротеинов
Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие свою собственную функцию:
1. Структурная функция («стационарные» белки) – связывают липиды и формируют белок-липидные комплексы:
- апоВ-48 – присоединяет триациллицеролы,
- апоВ-100 – связывает как триацилглицеролы, так и эфиры холестерина,
- апоА-I – акцептирует фосфолипиды,
- апоА-IV – связывается с холестеролом.
2. Кофакторная функция («динамические» белки) – влияют на активность ферментов метаболизма липопротеинов в крови:
- апоС-II — кофактор гепаринзависимой липопротеинлипазы,
- апоС-III – кофактор печеночной ТАГ-липазы и ингибитор липопротеинлипазы,
- апоА-I, апоА-II и апоС-I – кофакторы лецитин-холестерол-ацилтрансферазы,
- апоЕ – ингибитор липопротеинлипазы.
3. Векторная функция (белки-маркеры, стационарные) – обеспечивают направленный транспорт липопротеинов:
- апоВ-48, апоВ-100 и апоА-I – связываются со своими рецепторами клеток-мишеней,
- апоЕ помогает взаимодействию векторных апобелков с рецепторами.
Хиломикроны и ЛПОНП переносят триацилглицеролы
Транспорт триацилглицеролов от кишечника к тканям (экзогенные ТАГ) осуществляется в виде хиломикронов (ХМ), от печени к тканям (эндогенные ТАГ) – в виде липопротеинов очень низкой плотности.
В транспорте ТАГ к тканям можно перечислить последовательность следующих событий:
- Образование незрелых первичных ХМ в кишечнике.
- Движение первичных ХМ через лимфатические протоки в кровь.
- Созревание ХМ в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
- Взаимодействие ХМ с липопротеинлипазой (ЛПЛ) эндотелия кровеносных сосудов, которая отщепляет жирные кислоты от ТАГ. Далее жирные кислоты проникают непосредственно в клетки данной ткани или, связываясь с альбумином, разносятся по организму. В результате количество ТАГ в хиломикроне резко снижается, образуются остаточные ХМ.
- Переход остаточных ХМ в гепатоциты и полный распад их структуры.
- Синтез ТАГ в печени из пищевой глюкозы. Использование липидов, пришедших в составе остаточных ХМ.
- Образование первичных ЛПОНП в печени.
- Созревание ЛПОНП в плазме крови – получение белков апоС-II и апоЕ от ЛПВП.
- Взаимодействие с липопротеинлипазой эндотелия и потеря большей части ТАГ. Образование остаточных ЛПОНП (по-другому липопротеины промежуточной плотности, ЛППП).
- Далее остаточные ЛПОНП
- переходят в гепатоциты и полностью распадаются,
- либо остаются в плазме крови и превращаются в ЛПНП.
Схема транспорта экзогенных и эндогенных триацилглицеролов
(цифрами обозначены события соответственно тексту)
Характеристика хиломикронов
Общая характеристика
- формируются в кишечнике из ресинтезированных жиров,
- яявляются самыми крупными липопротеинами, их размер от 100 до 1200 нм (0,1-1,2 мкм),
- в их составе преобладают ТАГ, мало белка, фосфолипидов и холестерола (2% белка, 87% ТАГ, 2% ХС, 5% эфиров ХС, 4% фосфолипидов),
- основным апобелком является апоВ-48, это структурный липопротеин, в плазме крови получают от ЛПВП белки апоС-II и апоЕ,
- в норме натощак не обнаруживаются, в крови появляются после приема пищи, поступая из лимфы через грудной лимфатический проток, и полностью исчезают через 10-12 часов,
- не атерогенны.
Функция
Транспорт экзогенных ТАГ из кишечника в ткани, запасающие или использующие жирные кислоты, в основном в жировую ткань, миокард, скелетные мышцы и лактирующую молочную железу, в меньшей степени в легкие, костный мозг, почки, селезенку. На эндотелии капилляров этих тканей имеется фермент липопротеинлипаза.
NB! Количество липопротеинлипазы в жировой ткани увеличивается при действии инсулина и прогестерона.
Активность фермента здесь также возрастает при регулярном потреблении алкоголя (в эксперименте ежедневно по две условные единицы спирта), и как побочный эффект происходит одновременное повышение в крови антиатерогенных ЛПВП.
При действии адреналина в жировой ткани активность липопротеинлипазы снижается. У мужчин относительное количество фермента в жировой ткани по сравнению с мышечной ниже, чем у женщин (влияние тестостерона).
Частые физические нагрузки, даже низкой интенсивности (умеренная ходьба), быстро повышают активность фермента в скелетных мышцах (влияние СТГ и адреналина) и сжигание жиров в мышцах. И, наоборот, даже относительно недолгая гиподинамия в разы снижает здесь его активность, что открывает путь к эффективному усвоению хиломикронов и ЛПОНП в жировой ткани и ускоряет ожирение.
Для поддержания высокой активности липопротеинлипазы в мышечной ткани намного важнее меньше сидеть, чем интенсивно тренироваться.
Метаболизм
1. После ресинтеза жиров в эпителиоцитах кишечника формируются первичные хиломикроны, имеющие только апоВ-48.
2. Из-за большого размера они не проникают напрямую в кровеносное русло и эвакуируются через лимфатическую систему, попадая в кровь через грудной лимфатический проток.
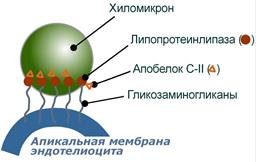
Взаимодействие хиломикрона и липопротеинлипазы
3. В крови хиломикроны взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы. Белок апоС-II является активатором фермента липопротеинлипазы, белок апоЕ понадобится для удаления из крови остаточных хиломикронов.
4. На эндотелии капилляров вышеперечисленных тканей находится фермент липопротеинлипаза (ЛПЛ), отщепляющая жирные кислоты от ТАГ в положении 1 и 3, в результате накапливаются моно- и диацилглицеролы.
5. Находясь в плазме крови, хиломикроны также взаимодействуют с ЛПВП, отдавая им часть своих МАГ и ДАГ и получая взамен эфиры ХС.
6. После взаимодействия хиломикрона с липопротеинлипазой полученные свободные жирные кислоты проникают в клетки органа, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани. Липопротеинлипаза способна расщепиить до 90% всех ТАГ, находящихся в хиломикроне.
7. Остаточные (ремнантные) хиломикроны, сохранившие в своем составе МАГ и ДАГ, попадают в гепатоциты посредством апоЕ-рецепторного эндоцитоза и разрушаются до составных частей.
8. Часть фосфолипидной оболочки ремнантных хиломикронов, содержащая апоС-II и апоЕ, способна «отрываться» от основной частицы и формировать первичные ЛПВП.
Характеристика липопротеинов очень низкой плотности
Общая характеристика
Липопротеины очень низкой плотности:
- синтезируются в печени из эндогенных и экзогенных липидов,
- в их составе преобладают ТАГ, около 40% от массы составляют белок, фосфолипиды и холестерол (8% белка, 60% ТАГ, 6% ХС, 12% эфиров ХС, 14% фосфолипидов),
- основным белком является апоВ-100, выполняющий структурную функцию,
- в норме концентрация 1,3-2,0 г/л,
- слабо атерогенны.
Функция
Транспорт эндогенных и экзогенных ТАГ от печени в ткани, запасающие и использующие жирные кислоты, т.е. в те же ткани, что и хиломикроны.
Метаболизм
1. Первичные ЛПОНП образуются в печени и содержат только апоВ-100. Липидный компонент синтезируется
- из пищевых липидов, МАГ и ДАГ, пришедших в гепатоциты с остаточными хиломикронами,
- из липидов, синтезируемых из глюкозы.
2. В крови первичные ЛПОНП взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы.
3. Аналогично хиломикронам, на эндотелии капилляров ряда тканей зрелые ЛПОНП подвергаются воздействию липопротеинлипазы с образованием свободных жирных кислот. Жирные кислоты перемещаются в клетки органа, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани.
4. При действии липопротеинлипазы в составе ЛПОНП снижается количество ТАГ и нарастает доля МАГ и ДАГ. Зрелый ЛПОНП превращается в остаточный (ремнантный) ЛПОНП.
5. Находясь в плазме крови, ЛПОНП взаимодействуют с ЛПВП, отдавая им часть своих МАГ и ДАГ и получая взамен эфиры ХС.
6. Остаточные ЛПОНП (также называемые липопротеины промежуточной плотности, ЛППП) в соотношении примерно 50 на 50
- либо попадают в гепатоциты посредством эндоцитоза, связанного со смешанным рецептором к апоЕ и апоВ-100-белкам,
- либо после воздействия на них печеночной липазы, находящейся в синусоидах печени, превращаются в следующий класс липопротеинов – липопротеины низкой плотности (ЛПНП).
Нарушения обмена ТАГ часто связаны с образом жизни
Жировая инфильтрация печени
Жировая инфильтрация печени (жировой гепатоз, стеатоз печени, жировая дистрофия) заключается в накоплении в цитозоле и межклеточном пространстве печени триацилглицеролов в виде жировых капель и в функциональной невозможности клеток их удалить. Последствием являются нарушение функций гепатоцитов, стеатогепатит с фиброзом, киста, цирроз печени и печеночная недостаточность.
Главной причиной жировой инфильтрации печени является метаболический блок синтеза ЛПОНП, ответственных за транспорт ТАГ из печени. Так как ЛПОНП включают разнородные соединения, то блок может возникнуть на разных уровнях синтеза:
- нарушение секреции липопротеинов в кровь – патологии мембран гепатоцитов при активации перекисного окисления липидов вследствие недостаточности антиоксидантных систем (в первую очередь гиповитаминозы С, А, Е, дефицит цинка и железа),
- часто причиной может быть относительная недостаточность апобелков и фосфолипидов при избытке ТАГ: при избыточном синтезе жирных кислот из глюкозы, при поступлении готовых жирных кислот из крови (немотивированный липолиз в жировой ткани), избыточное потребление жирной пищи, синтез повышенного количества ХС,
- недостаток апобелков – нехватка белка или незаменимых аминокислот в пище, воздействие токсинов и ингибиторов синтеза белка,
- снижение синтеза фосфолипидов – абсолютная или относительная недостаточность липотропных факторов (витаминов В6, В9, В12, метионина, полиненасыщенных жирных кислот), из-за чего не формируется оболочка липопротеинов,
- блок сборки липопротеиновых частиц в ЭПР при воздействии токсинов (хлороформ, мышьяк, свинец).
Принцип лечения
При лечении жировой инфильтрации необходимо:
- соблюдение водного режима – 25-30 мл чистой воды в сутки на 1 кг массы тела,
- снизить концентрацию липидов в крови – увеличение физических нагрузок,
- обеспечить удаление жирных кислот из гепатоцитов – прием липотропных факторов и полноценного белка,
- предотвратить синтез и накопление ТАГ в печени – диета со снижением жирных и сладких продуктов,
- при токсических поражениях – лечение гепатотропными лекарственными средствами.
NB! С приходом глобальной эпидемии ожирения неалкогольная жировая инфильтрация печени человека стала существенной медицинской проблемой. Она в основном встречается в индустриально развитых странах и находится в тройке самых частых заболеваний печени.
Эту патологию можно сравнить с кулинарным деликатесом фуа-гра (франц. «foie-gras» – жирная печень), который появился еще в Древнем Египте и заключается в принудительном кормлении утки или гуся через зонд жирной пищей. В результате инфильтрации жиром получается блестяще-розовая печень с нежным вкусом и консистенцией.
Ожирение
Ожирение – избыточное количество нейтрального жира в подкожной жировой клетчатке. Выделяют два типа ожирения – первичное и вторичное.
Первичное ожирение
Является следствием нарушения баланса энергии в результате гиподинамии и переедания. В здоровом организме количество поглощаемой пищи регулируется гормоном адипоцитов лептином. Лептин вырабатывается в ответ на увеличение жировой массы в клетке и, в конечном итоге, подавляет пищевое поведение, снижая в гипоталамусе образование нейропептида Y, который стимулирует поиск пищи. У 80% лиц с первичным ожирением гипоталамус приобретает нечувствительность к лептину, у 20% имеется дефект структуры лептина.
NB! Лептин также повышает тонус сосудов и увеличивает артериальное давление.
Характерным примером малопатогенного ожирения служит тучность борцов-сумоистов. Несмотря на явный избыток веса, мастера сумо долго сохраняют относительно хорошее здоровье благодаря тому, что не испытывают гиподинамии, а прирост веса связан исключительно со специальной диетой, обогащенной полиненасыщенными жирными кислотами. Но после прекращения спортивной карьеры для сохранения здоровья им приходится возвращать вес к общечеловеческим нормам. И, тем не менее, последствия былой избыточной массы тела проявляются с возрастом.
Вторичное ожирение
Возникает при гормональных заболеваниях. К таким заболеваниям относятся, например, гипотиреоз (болезнь Хашимото), гиперкортицизм (синдром Кушинга).
Принцип лечения
При лечении ожирения в первую очередь необходимо учитывать тот факт, что любое ожирение – это вопрос баланса, т.е. прихода и расхода энергии.
- увеличение физической нагрузки — оптимально 3 раза в день по 20-30 мин до состояния легкой усталости, при этом нагрузка должна быть аэробной и по мере снижения веса тела интенсивность нагрузки должна нарастать,
- диета с резким уменьшением количества сладких продуктов и насыщенных жиров (молочные продукты, сыр, сливочное масло, сало, жирное мясо) при умеренном потреблении черного хлеба, злаковых, круп, растительных масел и рыбы, введение в рацион жирных кислот ω3-ряда, облегчающих липолиз,
- возможен прием биологически активных пищевых добавок (БАД) подавляющих липогенез, стимулирующих липолиз и окисление жирных кислот (цитримакс, гуарана, L-карнитин), поливитаминных и полиминеральных препаратов при обязательной физической нагрузке,
- при вторичном ожирении обязательно лечение основного заболевания.
NB! В шотландской клинике Мэрифилд в 1965-1966гг пациент Энгус Барбьери 382 дня потреблял только чай, кофе, содовую воду и витамины и похудел с 214,1 кг до 87,4 кг.
Инсулиннезависимый сахарный диабет
Основной причиной сахарного диабета II типа считается генетическая предрасположенность – у родственников больного риск заболеть возрастает на 50%.
Однако диабет не возникнет, если не будет частого и/или длительного повышения глюкозы в крови, что бывает при несбалансированном питании. При таком питании накопление жира в адипоците является «стремлением» организма предотвратить гипергликемию. При этом неизбежные изменения метаболизма и мембран адипоцитов ведут к нарушению связывания инсулина с рецепторами, развивается инсулинорезистентность. Нарастающая гипергликемия и компенсаторная гиперсекреция инсулина приводят к усилению липогенеза.
Одновременно фоновый (спонтанный, базальный) липолиз в разросшейся жировой ткани вызывает увеличение концентрации насыщенных жирных кислот в крови. Эти кислоты встраиваются в мембраны мышечных и жировых клеток, что также способствует инсулинорезистентности.
Таким образом, два противоположных процесса – липолиз и липогенез – усиливаются и обусловливают развитие сахарного диабета II типа.
Принцип лечения
Лечение сахарного диабета II типа должно включать все те же мероприятия, что и при лечении ожирения. При высоком уровне глюкозы обязательно применение гипогликемических средств (глибенкламид, диабетон и т.п.)
Синтез холестерола должен быть согласован с его выведением
Синтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут.
Единственным реальным способом выведения холестерола является желчь – до 1 г/сут.
Биосинтез холестерола
Биосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН.
Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов.
1. Синтез мевалоновой кислоты.
Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза (ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.
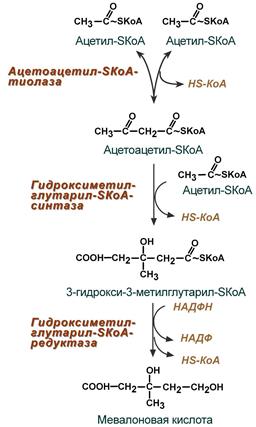 | 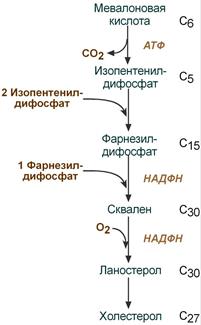 |
Реакции синтеза мевалоновой кислоты | Схема реакций синтеза холестерола |
2. Синтез изопентенилдифосфата. На этом этапе при использовании АТФ мевалоновая кислота трижды фосфорилируется. Затем промежуточный продукт декарбоксилируется и дефосфорилируется с получением изопентенилдифосфата.
3. После объединения трех молекул изопентенилдифосфата (если не считать промежуточных превращений) синтезируется фарнезилдифосфат.
4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата.
5. После сложных реакций линейный сквален циклизуется в ланостерол.
6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола.
Регуляция синтеза
Регуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз.
1. Метаболическая регуляция – по принципу обратной отрицательной связи фермент аллостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным.
2. Регуляция транскрипции гена ГМГ-SКоА-редуктазы (в печени) – холестерол и желчные кислоты подавляют считывание гена и уменьшают количество фермента.
3. Ковалентная модификация при гормональной регуляции:
- Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние.
- Глюкагон и адреналин посредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму.
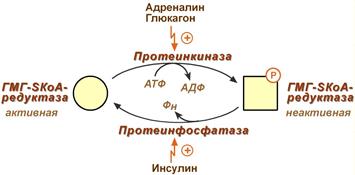
Регуляция активности гидроксиметилглутарил-S-КоА-редуктазы
Кроме указанных гормонов, на ГМГ-SКоА-редуктазу действуют эстрогены и тиреоидные гормоны (повышают активность) и глюкокортикоиды (снижают активность).
NB! Изменение транскрипции гена ГМГ-КоА редуктазы (генетическая регуляция) осуществляется стерол-регулируемым элементом в ДНК (SREBP, sterol regulatory element-binding protein) с которым способны связываться белки — факторы SREBP. Эти факторы при достаточном количестве холестерина в клетке закреплены в мембране ЭПР. Когда уровень холестерина падает, факторы SREBP активируются под действием специфичных протеаз комплекса Гольджи, передвигаются в ядро, взаимодействуют на ДНК с участком SREBP и стимулируют биосинтез холестерина.
Скорость биосинтеза холестерола также зависит от концентрации специфического белка-переносчика, обеспечивающего связывание и транспорт гидрофобных промежуточных метаболитов синтеза.
Холестерол используется как переносчик полиненасыщенных жирных кислот
Транспорт холестерола и его эфиров осуществляется липопротеинами низкой и высокой плотности.
Липопротеины высокой плотности
Общая характеристика
- образуются в печени de novo, в плазме крови при распаде хиломикронов, некоторое количество в стенке кишечника,
- в составе частицы примерно половину занимают белки, еще четверть фосфолипиды, остальное холестерин и ТАГ (50% белка, 25% ФЛ, 13% эфиров ХС и 5% свободного ХС, 7% ТАГ),
- структурным апобелком является апо А1, также содержат апоЕ и апоСII.
Функция
- Транспорт свободного ХС от тканей к печени.
- Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов.
Метаболизм
1. Синтезированные в печени частицы (насцентные или первичные ЛПВП) содержат в основном фосфолипиды и апобелки. Остальные липидные компоненты накапливаются в ЛПВП по мере метаболизма в плазме крови.
2-3. В плазме крови насцентный ЛПВП сначала превращается в ЛПВП3 (условно его можно назвать «зрелый»). В этом превращении главным является то, что ЛПВП
- забирает от клеточных мембран свободный холестерин при непосредственном контакте или при участии специфических транспортных белков,
- взаимодействуя с мембранами клеток, отдает им часть фосфолипидов из своей оболочки, доставляя таким образом полиеновые жирные кислоты в клетки,
- тесно взаимодействует с ЛПНП и ЛПОНП, получая от них свободный холестерин. В обмен ЛПВП3 отдают эфиры ХС, образованные благодаря переносу жирной кислоты от фосфатидилхолина (ФХ) на холестерин (ЛХАТ-реакция, см п.4).
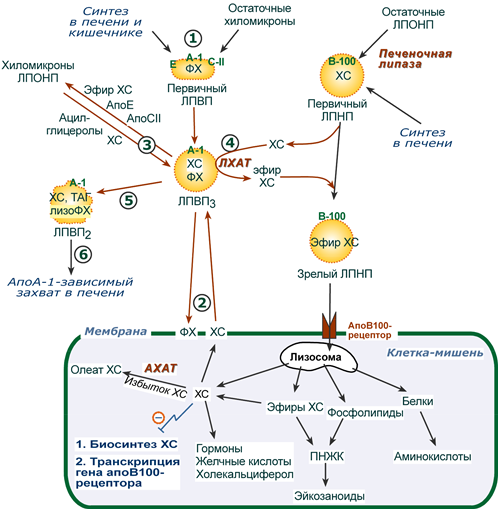
Транспорт холестерола и его эфиров в организме
(цифры соответствуют пунктам метаболизма ЛПВП по тексту)
4. Внутри ЛПВП активно протекает реакция при участии лецитин:холестерол-ацилтрансферазы (ЛХАТ-реакция). В этой реакции остаток полиненасыщенной жирной кислоты переносится от 2-го положения фосфатидилхолина (из оболочки самого ЛПВП) на получаемый свободный холестерин с образованием лизофосфатидилхолина (лизоФХ) и эфиров ХС. ЛизоФХ остается внутри ЛПВП, эфир холестерина отправляется в ЛПНП.
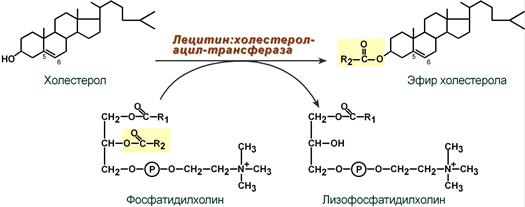
Реакция этерификации холестерола
при участии лецитин:холестерол-ацилтрансферазы
5. В результате первичный ЛПВП постепенно, через зрелую форму ЛПВП3, преобразуется в ЛПВП2 (остаточный, ремнантный). При этом происходят и дополнительные события:
- взаимодействуя с разными формами ЛПОНП и ХМ, ЛПВП получают ацил-глицеролы (МАГ, ДАГ, ТАГ), и обмениваются холестерином и его эфирами,
- ЛПВП отдают апоЕ- и апоСII-белки на первичные формы ЛПОНП и ХМ, и потом забирают обратно апоСII-белки от остаточных форм.
Таким образом, при метаболизме ЛПВП в нем происходит накопление свободного ХС, МАГ, ДАГ, ТАГ, лизоФХ и утрата фосфолипидной оболочки. Функциональные способности ЛПВП снижаются.
6. Далее ЛПВП2 захватывается гепатоцитами при помощи апоА-1-рецептора, происходит эндоцитоз и частица разрушается.
Липопротеины низкой плотности
Общая характеристика
- образуются в гепатоцитах de novo и в сосудистой системе печени под воздействием печеночной ТАГ-липазы из ЛПОНП,
- в составе преобладают холестерол и его эфиры, другую половину массы делят белки и фосфолипиды (38% эфиров ХС, 8% свободного ХС, 25% белки, 22% фосфолипидов, 7% триацилглицеролов),
- основным апобелком является апоВ-100,
- нормальное содержание в крови 3,2-4,5 г/л,
- самые атерогенные.
Функция
1. Транспорт холестерола в клетки, использующих его
- для реакций синтеза половых гормонов (половые железы), глюкокортикоидов и минералокортикоидов (кора надпочечников),
- для превращения в холекальциферол (кожа),
- для образования желчных кислот (печень),
- для выведения в составе желчи (печень).
2. Транспорт полиеновых жирных кислот в виде эфиров ХС в некоторые клетки рыхлой соединительной ткани (фибробласты, тромбоциты, эндотелий, гладкомышечные клетки), в эпителий гломерулярной мембраны почек, в клетки костного мозга, в клетки роговицы глаз, в нейроциты, в базофилы аденогипофиза.
Клетки рыхлой соединительной ткани активно синтезируют эйкозаноиды. Поэтому им необходим постоянный приток полиненасыщенных жирных кислот (ПНЖК), что осуществляется через апо-В-100-рецептор, т.е. регулируемым поглощением ЛПНП, которые несут ПНЖК в составе эфиров холестерола.
NB! Особенностью клеток, поглощающих ЛПНП, является наличие лизосомальных кислых гидролаз, расщепляющих эфиры ХС. У других клеток таких ферментов нет.
Иллюстрацией значимости транспорта ПНЖК в указанные клетки служит ингибирование салицилатами фермента циклооксигеназы, образующей эйкозаноиды из ПНЖК. Салицилаты успешно применяются в кардиологии для подавления синтеза тромбоксанов и снижения тромбообразования, при лихорадке, как жаропонижающее средство за счет расслабления гладких мышц сосудов кожи и повышения теплоотдачи. Однако одним из побочных эффектов тех же салицилатов является подавление синтеза простагландинов в почках и снижение почечного кровобращения.
Также в мембраны всех клеток, как сказано выше (см «Метаболизм ЛПВП»), ПНЖК могут переходить в составе фосфолипидов от оболочки ЛПВП.
Метаболизм
1. В крови первичные ЛПНП взаимодействуют с ЛПВП, отдавая свободный ХС и получая этерифицированный. В результате в них происходит накопление эфиров ХС, увеличение гидрофобного ядра и «выталкивание» белка апоВ-100 на поверхность частицы. Таким образом, первичный ЛПНП переходит в зрелый.
2. На всех клетках, использующих ЛПНП, имеется высокоафинный рецептор, специфичный к ЛПНП – апоВ-100-рецептор. Около 50% ЛПНП взаимодействует с апоВ-100-рецепторами разных тканей и примерно столько же поглощается гепатоцитами.
3. При взаимодействии ЛПНП с рецептором происходит эндоцитоз липопротеина и его лизосомальный распад на составные части – фосфолипиды, белки (и далее до аминокислот), глицерол, жирные кислоты, холестерол и его эфиры.
- ХС превращается в гормоны или включается в состав мембран,
- излишки мембранного ХС удаляются с помощью ЛПВП,
- принесенные с эфирами ХС ПНЖК используются для синтеза эйкозаноидов или фосфолипидов.
- при невозможности удалить ХС часть его этерифицируется с олеиновой или линолевой кислотами ферментом ацил-SКоА:холестерол-ацилтрансферазой (АХАТ-реакция),
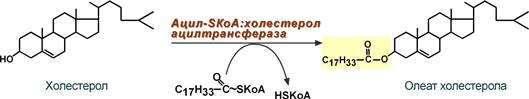
Синтез олеата холестерола при участии
ацил-SKoA-холестерол-ацилтрансферазы
NB! На количество апоВ-100-рецепторов влияют гормоны:
- инсулин, тиреоидные и половые гормоны стимулируют синтез этих рецепторов,
- глюкокортикоиды уменьшают их количество.
Нарушения обмена холестерола имеют тяжелые последствия
Одним из самых ярких и клинически значимых нарушений обмена липопротеинов является атеросклероз.
Атеросклероз
Атеросклероз – это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка на стенку (по убыванию воздействия): абдоминальная аорта, коронарная артерия, подколенная артерия, бедренная артерия, тибиальная артерия, грудная аорта, дуга грудной аорты, сонные артерии.
Стадии атеросклероза
Морфологически выделяют четыре стадии атеросклероза. Первая и вторая стадии распространены широко и при правильном питании являются обратимыми, 3 и 4 стадии уже имеют клиническое значение и необратимы.
1 стадия – повреждение эндотелия
Это «долипидная» стадия, обнаруживается даже у годовалых детей. Изменения этой стадии неспецифичны и ее могут вызывать: дислипопротеинемия, гипертензия, повышение вязкости крови, курение, вирусные и бактериальные инфекции, свинец, кадмий и т.п.
На этой стадии в эндотелии создаются зоны повышенной проницаемости и клейкости. Внешне это проявляется в разрыхлении и истончении (вплоть до исчезновения) защитного гликокаликса на поверхности эндотелиоцитов, расширении межэндотелиальных щелей. Это приводит к усилению выхода моноцитов и липопротеинов (ЛПНП и ЛПОНП) в интиму.
2 стадия – стадия начальных изменений
Отмечается у большинства детей и молодых людей.
Поврежденный эндотелий и активированные тромбоциты вырабатывают медиаторы воспаления, факторы роста, эндогенные окислители. В результате через поврежденный эндотелий в интиму сосудов еще более активно проникают моноциты и способствуют развитию воспаления. При этом ЛПНП, попавшие под интиму, начинают изменяться (модифицироваться), т.е. подвергаются окислению, гликозилированию, ацетилированию.
Моноциты, преобразуясь в макрофаги, активно поглощают измененные липопротеины при участии «мусорных» рецепторов (scavenger [‘skævɪnʤə] receptors). Таким образом, поглощение модифицированных ЛПНП макрофагами идет без участия апоВ-100-рецепторов, а, значит, нерегулируемо.
При поглощении модифицированных липопротеинов макрофаги активируются, выделяют цитокины и разнообразные факторы роста, которые стимулируют деление гладкомышечных клеток, синтез межклеточного вещества, и играют роль в развитии атеросклеротической бляшки.
Гликозилирование белков ЛПНП ускоряется при сахарном диабете или при других хронических гипергликемиях. Такие модифицированные липопротеины теряют способность связываться с апоВ-100-рецептором и проникать в клетки-мишени и, в результате, накапливаются в крови и в интиме сосудов.
Под действием факторов роста гладкомышечные клетки медии мигрируют в интиму и начинают пролиферировать, превращаясь в макрофагоподобные клетки. Они также накапливают модифицированные ЛПНП.
Накопление липидов в макрофагах быстро исчерпывает невысокие возможности клеток по утилизации свободного и этерифицированного ХС. Они переполняются стероидами и превращаются в пенистые клетки. Внешне на эндотелии появляются липидные пятна и полоски.
Процесс развития атеросклероза, в динамике слева-направо.
(кликните на рисунок, чтобы увеличить)
3 стадия – стадия поздних изменений
Продолжают развертываться и приобретают масштабность события, начавшиеся на второй стадии.
Внешне проявляется как выступание поверхности в просвет сосуда. Стадия дополнительно характеризуется следующими особенностями:
- увеличение количества коллагена, эластина и гликозаминогликанов, т.е. накопление межклеточного вещества,
- пролиферация и гибель пенистых клеток (апоптоз),
- накопление в межклеточном пространстве свободного ХС и этерифицированного ХС,
- инкапсулирование холестерола и формирование фиброзной бляшки.
4 стадия – стадия осложнений
На этой стадии происходят:
- кальцификация бляшки и ее изъязвление, приводящее к эмболии сосудов,
- тромбоз из-за адгезии и активации тромбоцитов,
- разрыв сосуда.
Основы лечения
В лечении атеросклероза обязательно должны быть две составляющие: диета и медикаменты. Целью лечения является снижение концентрации общего ХС плазмы, ХС ЛПНП и ЛПОНП, повышение концентрации ЛПВП.
Диета
1. Обеспечение организма витаминами: аскорбиновой кислотой, пантотеновой (коэнзим А) и никотиновой (НАДФ) кислотами, что способствует превращению холестерола печени в желчные кислоты (синтез желчных кислот). Для снижения окислительной модификации ЛПНП необходим витамин Е.
2. Снижение калорийности пищи за счет углеводов и жиров. Жиры пищи должны включать равные доли насыщенных, мононенасыщенных и полиненасыщенных жирных кислот. Доля жидких жиров, содержащих полиненасыщенные жирные кислоты (ПНЖК), должна быть около 30% от всех жиров, но не меньше 15 г/сут. Роль ПНЖК в лечении гиперхолестеролемии и атеросклероза сводится к:
- ограничению всасывания ХС в тонком кишечнике,
- активации синтеза фосфатидилхолина, что снижает вязкость желчи и облегчает ее отток в кишечник,
- усилению желчеотделения,
- снижению синтеза ЛПНП в печени и секреции их в кровь,
- увеличению синтеза ЛПВП и концентрации их в крови, что способствует удалению холестерина из тканей в печень.
3. Обеспечение организма чистой водой до физиологических норм (1,0-1.5 л/сут), что препятствует сгущению желчи.
4. Потребление высоких количеств овощей, содержащих целлюлозу (капуста, морковь, свекла) для усиления перистальтики кишечника, стимуляции желчеотделения и снижения всасывания ХС.
5. Умеренная физическая нагрузка – способствует синтезу ЛПВП и, значит, оттоку холестерина от тканей в печень.
Медикаменты
1. Препараты ω6- и ω3-жирных кислот (Линетол, Эссенциале, Омеганол и т.п.) повышают концентрацию ЛПВП в плазме, ускоряют отток ЛПНП в печень, стимулируют желчеотделение.
2. Подавление всасывания ХС в желудочно-кишечном тракте – анионообменные смолы (Холестирамин, Холестид, Questran).
3. Высокие дозы никотиновой кислоты подавляют мобилизацию жирных кислот из депо и снижают синтез ЛПОНП в печени, а, следовательно, и образование из них ЛПНП в крови.
4. Фибраты (клофибрат и т.п.) увеличивают активность липопротеинлипазы, ускоряют катаболизм ЛПОНП и хиломикронов, что повышает переход холестерола из них в ЛПВП и его эвакуацию в печень.
5. Статины (ловастатин, флувастатин) ингибируют ГМГ-SКоА-редуктазу, что снижает в 2 раза синтез ХС в печени и ускоряют его отток из ЛПВП в гепатоциты.
NB! Предложены и совсем радикальные способы:
6. Подавление функции энтероцитов с помощью антибиотика неомицина, что снижает всасывание жиров.
7. Хирургическое удаление подвздошной кишки и прекращение реабсорбции желчных кислот.
Нарушения транспорта липидов
Нарушения обмена липопротеинов получили название дислипопротеинемий. Причинами дислипопротеинемий может быть изменение активности ферментов обмена липопротеинов – лецитин:холестерол-ацилтрансферазы (ЛХАТ) или липопротеинлипазы (ЛПЛ), снижение рецепции липопротеинов на клетках, нарушение синтеза апобелков.
Разнообразные дислипопротеинемии могут быть связаны как с повышением (гиперлипопротеинемии), так и со снижением (гипо— и алипопротеинемии) количества отдельных классов липопротеинов.
Подробно все нарушения описаны в разделе клинической биохимии — Дислипопротеинемии.