Как происходит транспорт аминокислот в клетку?
Транспорт аминокислот через мембраны клеток, как при всасывании из полости кишечника в энтероциты, так и при переходе из крови в клетки различных тканей, осуществляется при помощи двух механизмов: вторичный активный транспорт и глутатионовая транспортная система.
Транспорт аминокислот через мембраны
Вторичный активный транспорт
Вторичный активный транспорт – это перенос веществ, в данном случае аминокислот, с использованием градиента концентрации натрия между внутренней и наружной сторонами клеточной мембраны.
Вторичный активный транспорт основан на наличии низкой концентрации ионов натрия внутри клеток, создаваемой мембранным ферментом Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Важно то, что в отсутствие натрия аминокислота не в состоянии связаться с белком-переносчиком.
Затем, изменив свое положение в мембране, белок отдает ион натрия в цитозоль по градиенту концентрации. Сразу после этого аминокислота теряет связь с белком и остается в цитоплазме.
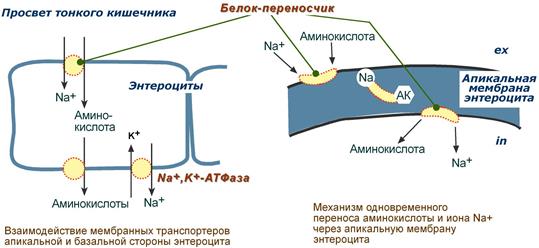
Вторичный активный транспорт аминокислот через мембраны
В настоящее время выделяют 5 транспортных систем:
- для крупных нейтральных, в том числе алифатических и ароматических аминокислот,
- для малых нейтральных – аланина, серина, треонина,
- для основных аминокислот – аргинина и лизина,
- для кислых аминокислот – аспартата и глутамата,
- для малых аминокислот – глицина, пролина и оксипролина.
Глутатионовая система транспорта
Второй способ переноса аминокислот внутрь клетки происходит в комплексе с глутатионом при помощи фермента γ-глутамилтрансферазы.
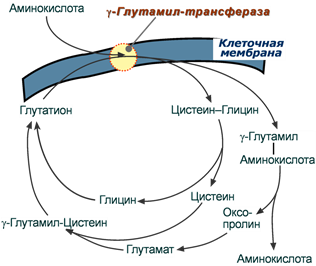
Вторичный активный транспорт аминокислот через мембраны
Переносчиком некоторых аминокислот (обычно нейтральных) по этой схеме является трипептид глутатион (γ-глутамилцистеилглицин). При взаимодействии глутатиона с аминокислотой на внешней стороне клеточной мембраны γ-глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки. Глутатион при этом распадается на составляющие. После отделения аминокислоты происходит ресинтез глутатиона.
Исследование активности γ-глутамилтрансферазы часто проводится в клинико-лабораторной диагностике заболеваний печени и почек.
Пути метаболизма аминокислот
Аминокислоты в клетке составляют динамичный пул, который непрерывно пополняется и так же непрерывно расходуется.
Существуют три источника аминокислот для пополнения этого пула – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот.
Путь дальнейшего превращения каждой аминокислоты зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
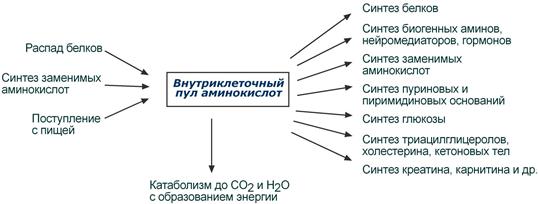
Возможные пути превращений аминокислот
Реакции превращения аминокислот в клетке условно можно разделить на три части, в зависимости от реагирующей группы:
- с участием аминогруппы — здесь подразумевается удаление от аминокислоты аминогруппы тем или иным способом, в результате чего остается углеводородный скелет,
- по боковой цепи (радикалу) — происходит использование углеродного скелета для синтеза глюкозы, жиров, или для образованеия энергии АТФ,
- по карбоксильной группе — связано с отщеплением карбоксильной группы.
Углероды аминокислот используются в разных процессах
Поскольку в организме присутствует 20 протеиногенных и еще больше непротеиногенных аминокислот, которые отличаются друг от друга строением бокового радикала, то существует аналогичное количество специфических путей для катаболизма этого радикала. В дальнейшем все эти пути сливаются и сходятся к шести продуктам, которые вступают в цикл трикарбоновых кислот, и здесь полностью окисляются до углекислого газа и воды с выделением энергии. Из общего количества энергии, образующейся в организме, на долю аминокислот обычно приходится около 10%.
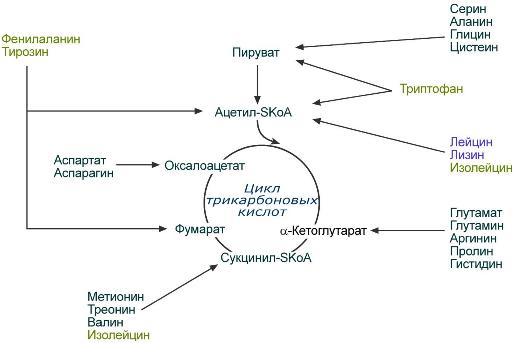
Пути превращений аминокислот по боковой цепи
При определенных условиях (голодание, длительный стресс, мышечная нагрузка) углеродный скелет многих аминокислот не окисляется полностью, а участвует в синтезе глюкозы (глюкогенные аминокислоты) и ацетил-SКоА (кетогенные аминокислоты).
К глюкогенным относятся аминокислоты (их большинство), при распаде которых образуются пируват и метаболиты ЦТК, например, оксалоацетат или α-кетоглутарат. В дальнейшем образующиеся метаболиты ЦТК могут уходить на синтез глюкозы (глюкогенные).
Строго кетогенными являются лизин и лейцин, при их окислении образуется исключительно ацетил-SКоА. Он принимает участие в синтезе кетоновых тел (кетогенные), жирных кислот и холестерола.
Также выделяют небольшую группу смешанных аминокислот, из них образуется пируват, метаболиты ЦТК и ацетил-SКоА (фенилаланин, тирозин, изолейцин, триптофан). Их разные атомы углерода могут включаться как в липиды, так и в глюкозу.
До 10% энергии в клетке образуется из аминокислот
NB! Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH2 – 2,0. По современным данным значение коэффициента P/O для НАДH соответствует 2,5, для ФАДH2 – 1,5.
При расчете энергетической ценности, т.е. количества АТФ, образующейся при окислении аминокислот, и коэффициента Р/О необходимо представлять себе весь путь аминокислоты до полного окисления всех ее углеродных атомов в СО2. При этом необходимо учитывать число атомов углерода в молекуле.
Например, аспартат содержит 4 атома углерода и поэтому его остатку необходимо пройти 2 оборота ЦТК, прежде чем они выделятся в виде СО2. Подсчитывая число восстановленных НАДН, ФАДН2 и ГТФ, образуемых в двух оборотах ЦТК, определяем сумму АТФ – 20 молекул. При расчете коэффициента Р/О учитываем только фосфат, включенный в АТФ ферментом АТФ-синтазой, т.е. в процессе окислительного фосфорилирования. Это значит, что фосфат, входящий в ГТФ, не учитывается!
И, наконец, помним, что каждая молекула восстановленного эквивалента (т.е. НАДН или ФАДН2) передает на дыхательную цепь по одной паре электронов, которые проходят разное расстояние: от НАДН – три комплекса ферментов, от ФАДН2 – 2 комплекса ферментов, но в любом случае восстанавливают до воды по одному атому кислорода
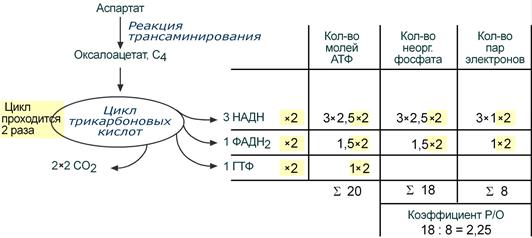
Расчет энергетического эффекта окисления аспарагиновой кислоты
Схожим образом рассчитываем требуемые значения суммы АТФ и коэффициента Р/О для аланина и глутамата.
Два атома углерода аланина попадают в ЦТК после того, как безазотистый остаток аланина – пируват – окислится в пируват-дегидрогеназном комплексе с образованием НАДН. Образованный ацетил-SКоА входит в ЦТК и полностью окисляется в одном его обороте. В результате в дыхательную цепь направляется 4 молекулы НАДН и 1 молекула ФАДН2.
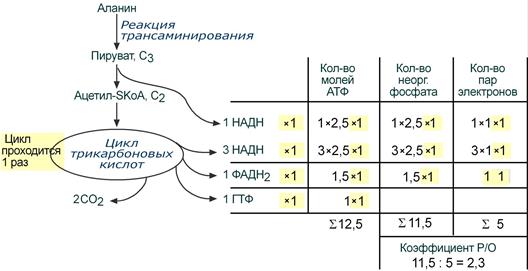
Расчет энергетического эффекта окисления аланина
В случае с глутаматом надо учесть, что α-кетоглутарат, образуемый из глутаминовой кислоты, является метаболитом цикла Кребса. Он сразу превращается в сукцинил-SКоА и далее по реакциям ЦТК до оксалоацетата. Для полного окисления оксалоацетата (С4) требуется два оборота ЦТК (2 × 2СО2).
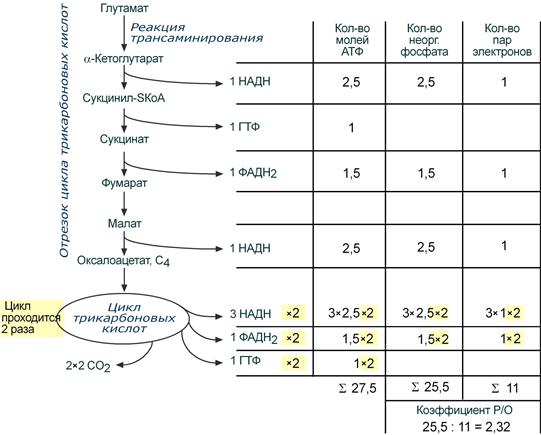
Расчет энергетического эффекта окисления глутаминовой кислоты
Биогенные амины образуются из аминокислот
Синтез биогенных аминов (нейромедиаторов) из аминокислот связан с вовлечением в метаболизм α-карбоксильной группы аминокислот или, проще говоря, ее удалением.
Гистамин
Реакция образования гистамина наиболее активно идет в тучных клетках легких, кожи, печени, базофилах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных гранулах.
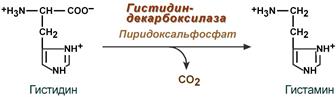
Реакция синтеза гистамина
В кровь гистамин выделяется при повреждении ткани, при ударе, при электрическом раздражении. В клинической практике секреция гистамина обычно связана с аллергиями – при повторном попадании антигена в ранее сенсибилизированный организм развивается аллергическая реакция.
Физиологические эффекты
- расширение артериол и капилляров и, как следствие, покраснение кожи, снижение артериального давления;
- повышение проницаемости стенки капилляров и, как следствие, выход жидкости в межклеточное пространство (отечность), снижение артериального давления;
- если предыдущие пункты имеют место в головном мозге – повышение внутричерепного давления;
- увеличивает тонус гладких мышц бронхов, как следствие – спазм и удушье;
- слабо повышает тонус мышц желудочно-кишечного тракта;
- стимулирует секрецию слюны и желудочного сока.
Серотонин
Серотонин активно синтезируется в тучных клетках кожи, легких, печени, в селезенке, ЦНС.
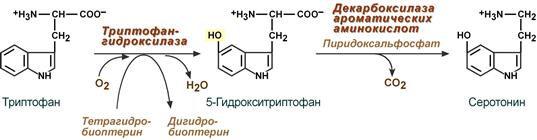
Реакции синтеза серотонина
Физиологические эффекты
- стимулирует сокращение гладких мышц желудочно-кишечного тракта и, как следствие, повышение перистальтики ЖКТ;
- выражено стимулирует сокращение гладких мышц сосудов, кроме сосудов миокарда и скелетных мышц и, как следствие, повышение артериального давления;
- слабо увеличивает тонус гладких мышц бронхов;
- в центральной нервной системе является тормозным медиатором;
- в периферических нервных окончаниях обусловливает возникновение боли и зуда (например, при укусе насекомых).
Гамма-аминомасляная кислота
Синтез γ-аминомасляной кислоты (ГАМК) происходит исключительно в центральной нервной системе в подкорковых образованиях головного мозга.
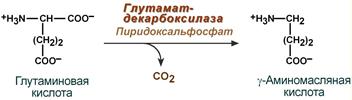
Реакция синтеза ГАМК
Физиологические эффекты
В центральной нервной системе ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором. Наиболее высока ее роль в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, ядрах мозжечка.
Дофамин
Синтез дофамина происходит в основном в нейронах промежуточного и среднего мозга.
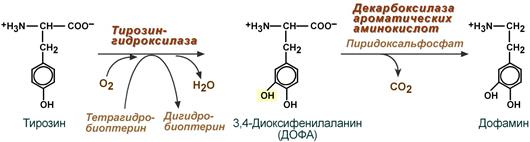
Реакции синтеза дофамина
Физиологические эффекты
Является медиатором дофаминовых рецепторов в подкорковых образованиях ЦНС, в больших дозах расширяет сосуды сердца, стимулирует частоту и силу сердечных сокращений, расширяет сосуды почек, увеличивая диурез.
Нейромедиаторы живут недолго
Существуют два способа инактивации биогенных аминов — дезаминирование и метилирование.
Дезаминирование протекает с образованием свободного аммиака и с участием ФАД. Катализирует реакцию моноаминоксидаза, она обнаружена во многих тканях, но наиболее активна в печени, желудке, почках, кишечнике, нервной ткани.
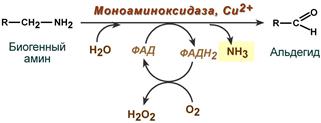
Реакция с участием моноаминоксидазы
Метилирование биогенного амина происходит при наличии у него гидроксильной группы (дофамин, серотонин). В реакции принимает участие активная форма метионина – S-аденозилметионин (SAM), образуется метилированная форма амина и S-аденозилгомоцистеин (SАГ).
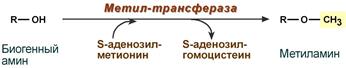
Реакция метилирования
Например, дофамин может обезвреживаться обоими указанными выше способами с образованием промежуточных метаболиов: 3,4-дигидроксифенилуксусной кислоты или 3-метокситирамина. Оба эти вещества превращаются в гомованилиновую кислоту.
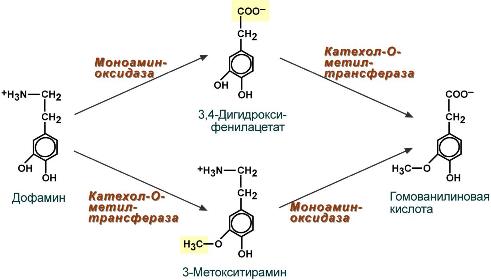
Схема реакций обезвреживания дофамина
Существуют 4 типа дезаминирования аминокислот
Превращение аминокислот с участием NH2-группы сводится к ее отщеплению от углеродного скелета в реакции дезаминирования.
Типы дезаминирования
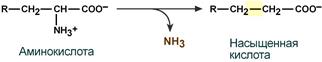
- внутримолекулярное – с образованием ненасыщенной жирной кислоты:
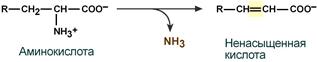
- восстановительное с образованием насыщенной жирной кислоты:
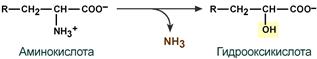
- гидролитическое – с образованием карбоновой гидроксикислоты:
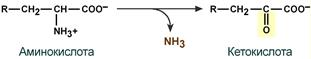
- окислительное с образованием кетокислот:
Не все аминокислоты подвергаются окислительному дезаминированию. Гистидин теряет аминогруппу использованием внутримолекулярного дезаминирования.
Треонин и серин либо дегидратируются с последующим отщеплением аммиака (прямое неокислительное дезаминирование), либо подвергаются прямому расщеплению до глицина и ацетальдегида (треонин) или до глицина и гидроксиметила (серин).
Катаболизм аминокислот начинается с дезаминирования
У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое и непрямое.
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН.
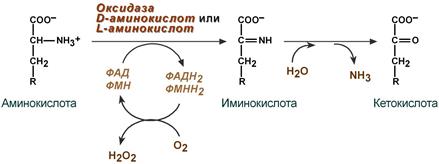
Реакция, катализируемая оксидазами D- и L-аминокислот
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования (см ниже).
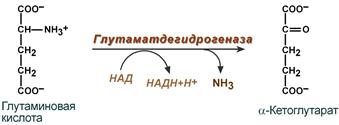
Реакция прямого окислительного дезаминирования
глутаминовой кислоты
В печени реакция используется для получения аммиака из его транспортной формы глутаминовой кислоты. Далее аммиак входит в реакции синтеза мочевины.
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Этот перенос называется трансаминирование и его механизм довольно сложен.
В качестве конечной кетокислоты-акцептора («кетокислота 2») в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат («аминокислота 2»).
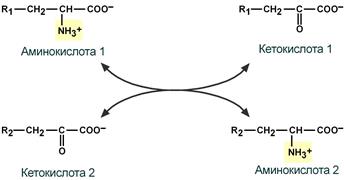
Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О.
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование.
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой (перейти вверх к ее реакции), которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
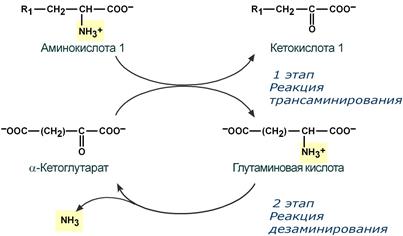
Схема обоих этапов трансдезаминирования
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования:
- активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
- обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
- начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
- необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
При патологиях (сахарный диабет 1 типа, гиперкортицизм) реакции трансаминирования обусловливают появление субстратов для глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
- является одной из транспортных форм аминного азота в гепатоциты,
- способна реагировать со свободным аммиаком, обезвреживая его (синтез глутамина).
Процесс трансдезаминирования идет в организме непрерывно, потому что:
- сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Для трансаминирования необходим витамин В6
Механизм реакции трансаминирования непрост и протекает по типу «пинг-понг«. Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
- к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
- на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
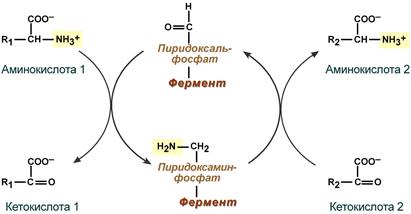
Схема реакции трансаминирования
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.

Превращение пиридоксальфосфата в пиридоксаминфосфат
при переносе аминогруппы от аминокислоты на кофермент
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
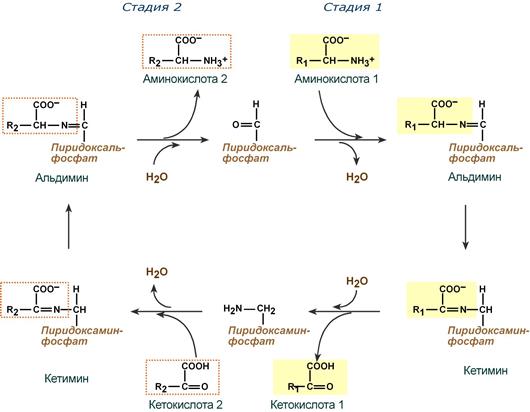
Реакции полного цикла трансаминирования
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
- пировиноградной с образованием аланина,
- щавелевоуксусной с образованием аспартата,
- α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Аминотрансферазы имеют клиническое значение
В лабораторной диагностике нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминотрансферазы (АСТ, АсАТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот.
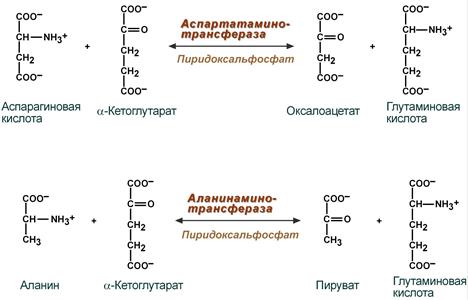
Реакции, катализируемые аланинаминотрансферазой
и аспартатаминотрансферазой
NB! В настоящее время аминотрансферазы теряют свое диагностическое значение в связи с низкой клинической специфичностью. Представленное ниже описание имеет в основном историческое значение.
Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при нарушении печени (гепатиты различного генеза) – для АЛТ.
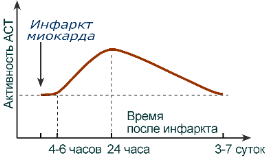
Изменение активности АСТ в сыворотке крови после инфаркта миокарда
В клинической практике определение активности АЛТ и АСТ используется для дифференциальной диагностики болезней печени и миокарда, глубины поражения и контроля эффективности их лечения.
Креатинфосфат - это запас взрывной энергии
Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфата креатин является «депо» макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки.
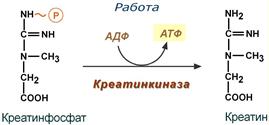
Использование креатинфосфата для ресинтеза АТФ
Особенно показательна роль креатина в мышечной ткани. Креатинфосфат обеспечивает срочный ресинтез АТФ в первые секунды работы (5‑10 сек), когда никакие другие источники энергии (анаэробный гликолиз, аэробное окисление глюкозы, β-окисление жирных кислот) еще не активированы, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода.
NB! При мышечной работе ионы Са2+, высвободившиеся из саркоплазматического ретикулума, являются активаторами креатинкиназы. Реакция еще интересна тем, что на ее примере можно наблюдать обратную положительную связь — активацию фермента продуктом реакции креатином. Это позволяет избежать снижения скорости реакции по ходу работы, которое должно было бы произойти по закону действующих масс из-за снижения концентрации креатинфосфата в работающих мышцах.
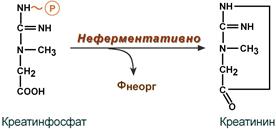
Образование креатинина из креатинфосфата
Около 3% креатинфосфата постоянно в реакции неферментативного дефосфорилирования превращается в креатинин. Количество креатинина, выделяемое здоровым человеком в сутки, всегда почти одинаково и зависит только от объема мышечной массы. Уровень активности креатинкиназы в крови и концентрация креатинина в крови и моче являются ценными диагностическими показателями.
Синтез креатина
Синтез креатина идет последовательно в почках и печени в двух трансферазных реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг.
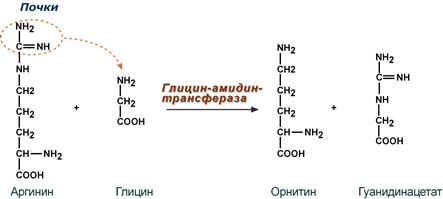
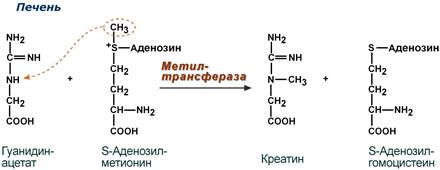
Реакции синтеза креатина в почках и печени
Здесь при наличии энергии АТФ (во время покоя или отдыха) он фосфорилируется с образованием креатинфосфата.
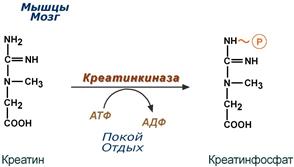
Синтез креатинфосфата
Если синтез креатина опережает возможность его фиксации в мышечной ткани, то развивается креатинурия – появление креатина в моче. Физиологическая креатинурия наблюдается в первые годы жизни ребенка. Иногда к физиологической относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина.
При заболеваниях мышечной системы (при миопатии или прогрессирующей мышечной дистрофии) в моче наблюдаются наибольшие концентрации креатина – патологическая креатинурия.
Дезаминирование аминокислот в мышце отличается от обычного
Так как в скелетных мышцах нет глутаматдегидрогеназы и нет возможности производить прямое дезаминирование аминокислот, то для этого существует особый путь.
В мышечных клетках при распаде мышечных белков активируется альтернативный способ дезаминирования аминокислот, связанный с пуриновым циклом АМФ-ИМФ. Образовавшийся при трансаминировании различных аминокислот глутамат при участии аспартатаминотрансферазы реагирует с оксалоацетатом и образуется аспарагиновая кислота. Аспартат далее передает свою аминогруппу на инозинмонофосфат (ИМФ) с образованием АМФ, который в свою очередь подвергается дезаминированию с образованием свободного аммиака.
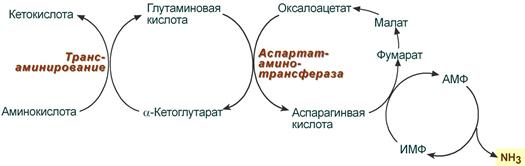
Реакции непрямого дезаминирования аминокислот в мышечной ткани
NB! Главной целью цикла АМФ-ИМФ является превращение аспарагиновой кислоты в фумарат и аммиак всякий раз, когда мышца начинает работать. Этот источник фумарата можно использовать многократно, потому что количество аспартата во много раз больше, чем пул промежуточных продуктов ЦТК, и постоянно пополняется из крови или при распаде мышечного белка. Таким образом, при повышенном расходе энергии в мышце фумарат, выходящий из цикла АМФ-ИМФ, используется для анаплеротического пополнения метаболитов ЦТК и позволяет ему развивать большую скорость.
Процесс играет защитную роль, т.к. при мышечной работе увеличивается выделение молочной кислоты. Аммиак, связывая ионы Н+, предотвращает закисление цитозоля миоцитов.
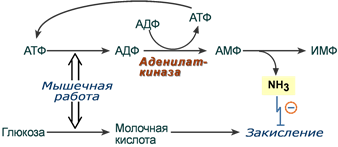
Появление аммиака в клетках непрерывно
Аммиак постоянно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными источниками аммиака являются следующие реакции:
- внутримолекулярное дезаминирование гистидина, катаболизм некоторых аминокислот (серина, треонина, глицина) – в печени,
- окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
- дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
- катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
- жизнедеятельность бактерий толстого кишечника,
- распад пуриновых и пиримидиновых оснований – во всех тканях.
Сначала аммиак требуется обезвредить
Для удаления аммиака из организма используется включение его в состав мочевины в печени и выведение ее с мочой, и удаление почками в виде аммонийных солей.
Однако, так как аммиак является чрезвычайно токсичным соединением, то предварительно в тканях (!) происходят реакции его обезвреживания (временного связывания) для переноса в печень и почки. – синтез глутаминовой кислоты и глутамина, синтез аспарагина:
- синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН.
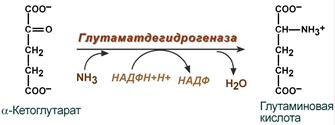
Реакция синтеза глутаминовой кислоты
Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата.
- синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
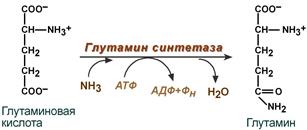
Реакция синтеза глутамина
- синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
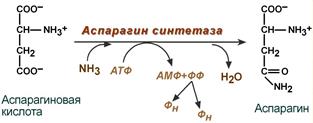
Реакция синтеза аспарагина
Связанный аммиак переносится в печень и почки
Транспорт аммиака
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Глутамин и аланин являются наиболее представленными, их доля среди всех аминокислот крови составляет до 50%. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аминный азот от мышц и стенки кишечника.
Глюкозо-аланиновый цикл
В мышцах основным акцептором лишнего аминного азота является пируват. При катаболизме белков в мышцах происходят реакции трансаминирования аминокислот, образуется глутамат, который далее передает аминоазот на пируват и образуется аланин. Из мышц с кровью аланин переносится в печень, где в обратной реакции передает свою аминогруппу на глутамат. Образующийся пируват используется как субстрат в реакциях синтеза глюкозы (глюконеогенез), а глутаминовая кислота дезаминируется и аммиак используется в синтезе мочевины.
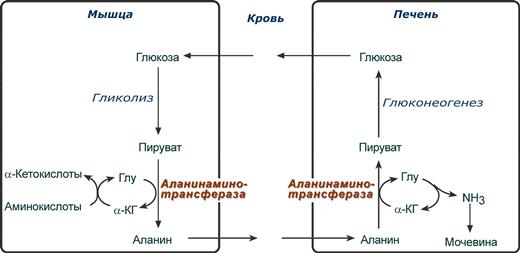
Реакции глюкозо-аланинового цикла (выделен рамкой).
Реакции, связанные с транспортными формами аммиака
Целевыми органами для транспорта аммиака являются печень, почки и кишечник.
В печени:
- аспарагин и глутамин дезаминируются соответственно аспарагиназой и глутаминазой, образующийся аммиак используется для синтеза мочевины ,
- аланин вступает в реакции трансаминирования с α-кетоглутаратом,
- глутаминовая кислота подвергается окислительному дезаминированию.
В кишечнике часть глутамина дезаминируется глутаминазой. После этого образованный аммиак выделяется в просвет кишечника (не более 5%) или через кровь воротной вены уходит в печень, а глутамат вступает в трансаминирование с пируватом, в результате чего аминоазот переходит на аланин и с ним также поступает в печень,
В почках идет образование аммонийных солей с использованием глутамата, глутамина и аспарагина.
Для удаления аммиака есть два способа
Практически весь аммиак удаляется из организма:
- с мочой в виде мочевины, которая синтезируется в печени,
- в виде образующихся в эпителии канальцев почек солей иона аммония.
В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах.
В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония).
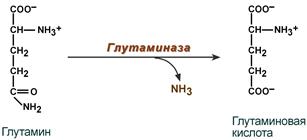
Реакция дезаминирования глутамина
Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота.
В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании α-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака.
Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Определение концентрации мочевины в крови является ценным диагностическим показателем.
Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
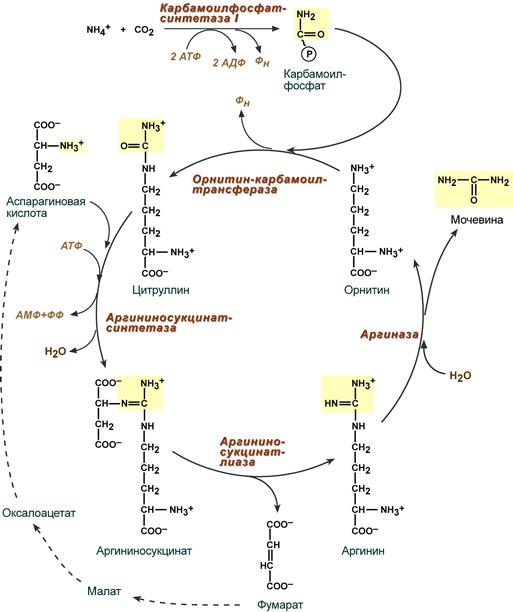
Реакция синтеза карбамоилфосфата и орнитиновый цикл
Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
NB! В противоположность аммиаку мочевина является нетоксичным и нейтральным соединением. При хронической почечной недостаточности, когда продукты азотистого обмена не выводятся из организма, токсичное действие на организм оказывает совсем не мочевина, а совокупность более чем 200 других веществ.
Синтез аммонийных солей
Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей.
Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза, гидролизующая амидную группу с образованием глутамата. Глутамат, в свою очередь, дезаминируется глутаматдегидрогеназой и полученный α-кетоглутарат сгорает в ЦТК. Также, особенно при голодании, α-кетоглутарат вовлекается в синтез глюкозы.
Параллельно в эпителии происходят процессы клеточного дыхания, сопровождающиеся образованием угольной кислоты, которая диссоциирует на ион Н+ и карбонат-ион НСО3−. Ионы водорода секретируются в первичную мочу, карбонат-ионы – в кровь.
Выделяемый аммиак
- либо диффундирует в просвет канальца, где соединяется с ионом Н+, образуя ионы аммония NH4+. Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот),
- либо связывается с ионом ионом Н+ в самой клетке, образуя ионы аммония NH4+, который секретируется в обмен на ионы Na+
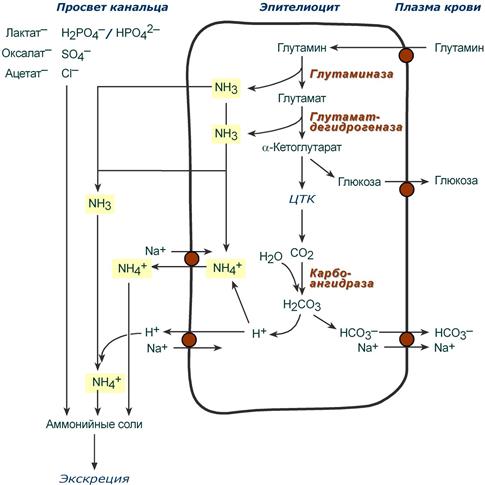
Реакции синтеза аммонийных солей
NB! При сдвигах кислотно-основного равновесия происходит адаптивное изменение активности глутаминазы. При ацидозе (закислении крови) необходимость выведения ионов Н+ вызывает увеличение синтеза фермента и возрастание экскреции солей аммония. При алкалозе (защелачивании крови) активность глутаминазы снижается и ионы Н+ сберегаются в организме.
Аммиак токсичен для организма
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость.
Гипотезы токсичности аммиака
Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Аммиак вызывает защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин – является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы.
Наследственные и приобретенные формы гипераммониемий
Приобретенные формы
Приобретенная (вторичная) гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений.
NB! Если у больного имеется сопутствующий цирроз печени (при котором развиваются коллатерали между воротной веной и большим кругом кровообращения), то развивается гипераммониемия.
Наследственные формы
Наследственные формы гипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния.
Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание сцеплено с Х-хромосомой, встречается с частотой от 1:14000 до 1:50000 (по разным данным). У матери также может наблюдаться гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения).
Лабораторным критерием гипераммониемий является накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче.
Основа лечения гипераммониемий сводится к ограничению белка в диете, уже это позволяет предотвратить многие нарушения мозговой деятельности.
| Заболевание | Дефект фермента | Тип наследо-вания | Клинические проявления | Метаболиты | |
| кровь | моча | ||||
| Гипераммони-емия, тип I | Карбамоил-фосфат-синтетаза I | Аутосомно-рецессивный | В течение 24-48 ч после рождения кома, смерть | Глн, Ала, NH3 | Оротат |
| Гипераммони-емия, тип II | Орнитин-карбамоил-трансфераза | Сцепленный с X-хромо-сомой | Гипотония, снижение толерантности к белкам | Глн, Ала, NH3 | Оротат |
| Цитруллин-емия | Аргинино-сукцинат-синтетаза | Аутосомно-рецессивный | Тяжелая гипераммониемия у ново-рожденных | Цитруллин, NH3 | Цитруллин |
| Аргинино-сукцинатурия | Аргинино-сукцинат-лиаза | Аутосомно-рецессивный | Гипераммониемия, атаксия, судороги, выпадение волос | Аргинино-сукцинат, NH3 | Аргинино-сукцинат, Глн, Ала, Лиз |
| Гипер-аргининемия | Аргиназа | Аутосомно-рецессивный | Гипераргининемия | Аргинино-сукцинат, NH3 | Лиз, Арг, Орнитин |